hbr что такое в химии
Бромоводород
| Бромоводород | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | бромоводород |
| Традиционные названия | Бромистый водород |
| Химическая формула | HBr |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ |
| Отн. молек. масса | 80,91 а. е. м. |
| Молярная масса | 80,91 г/моль |
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ |
| Термические свойства | |
| Температура плавления | –86.80 °C |
| Температура кипения | –66.38 °C |
| Критическая точка | 90,0 °C, 8,54 МПа |
| Энтальпия образования (ст. усл.) | -34,1 кДж/моль |
| Удельная теплота испарения | 17,61 кДж/моль |
| Удельная теплота плавления | 2,3 кДж/моль |
| Химические свойства | |
| pKa | ≈ –9 |
| Растворимость в воде | 193 (20 °C) г/100 мл |
| Структура | |
| Дипольный момент | 0,24 Д |
| Классификация | |
| Рег. номер CAS | 10035-10-6 |
| Рег. номер EINECS | 233-113-0 |
Бро́моводоро́д (HBr) — соединение брома с водородом. Бесцветный газ, образует туман в сыром воздухе.
Содержание
Получение
В промышленности бромоводород получают непосредственным взаимодействием элементов:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:

Восстановление брома несколькими способами:

Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород это бесцветный газ с резким запахом, сильно дымящийся на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:


Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы, со временем, окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Бромоводород» в других словарях:
бромоводород — vandenilio bromidas statusas T sritis chemija formulė HBr atitikmenys: angl. hydrobromic acid; hydrogen bromide rus. бромоводород; водорода бромид … Chemijos terminų aiškinamasis žodynas
бромоводород — (бромистый водород), HBr, бесцветный дымящий на воздухе газ с резким неприятным запахом, tпл –86,91°C, tкип –66,7°C. Водный раствор бромоводородная кислота. Применяют для синтеза бромидов, органических бромпроизводных … Энциклопедический словарь
БРОМОВОДОРОД — (бромистый водород), НВr, бесцв. дымящий на воздухе газ с резким неприятным запахом, tпл 86,91 °С, tкип 66,7 °С. Вод. р р бромоводородная кислота. Применяют для синтеза бромидов, органич. бромпроизводных … Естествознание. Энциклопедический словарь
бромоводород — бромистый водород … Cловарь химических синонимов I
бромистый водород — бромоводород … Cловарь химических синонимов I
Бромистый водород — Бромоводород Общие Систематическое наименование бромоводород Химическая формула … Википедия
Бромоводородная кислота — Бромоводород Общие Систематическое наименование бромоводород Химическая формула … Википедия
Пенополистирол — Структура пенополистирола при большом увеличении Пенополистирол лёгкий газонаполненный ма … Википедия
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
Йод — (хим.) один из элементов группы галоидов, химический знак J, атомный вес 127, по Стасу 126,85 (О = 16), открыт Куртуа в 1811 г. в маточном рассоле золы морских водорослей. Природа его, как элемента, установлена Гей Люссаком и им же ближе… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Бромистоводородная кислота (HBr) структура, свойства, образование, использование
В химических уравнениях он должен быть записан как HBr (ac), чтобы указать, что это бромистоводородная кислота, а не газ. Эта кислота является одной из самых сильных, даже больше, чем соляная кислота, HCl. Объяснение этому кроется в природе его ковалентной связи.
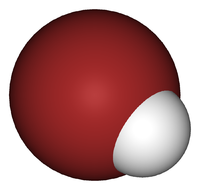
Почему HBr такая кислота и еще больше растворяется в воде? Поскольку ковалентная связь H-Br очень слабая, из-за плохого перекрытия 1s-орбиталей H и 4p Br.
Это неудивительно, если вы внимательно посмотрите на изображение выше, где атом брома (коричневый) явно больше, чем атом водорода (белый).
Бромистоводородная кислота, после HI, является одним из самых сильных и полезных гидроцидов для расщепления определенных твердых образцов..
Структура бромистоводородной кислоты
На изображении показана структура H-Br, свойства и характеристики которого, даже газа, тесно связаны с его водными растворами. Вот почему наступает момент, когда вы вступаете в заблуждение относительно того, на какое из двух соединений намекают: HBr или HBr (ac).
Структура HBr (ac) отличается от структуры HBr, потому что теперь молекулы воды сольватируют эту двухатомную молекулу. Когда это достаточно близко, H передается + к молекуле Н2Или как указано в следующем химическом уравнении:
кислотность
Физико-химические свойства
Молекулярная формула
Молекулярный вес
Внешний вид
Бесцветная или бледно-желтая жидкость, которая будет зависеть от концентрации растворенного HBr. Чем оно более желтое, тем более концентрированным и опасным оно будет.
запах
Порог запаха
плотность
1,49 г / см 3 (водный раствор при 48% мас. / мас.). Эта величина, как и те, которые соответствуют точкам плавления и кипения, зависит от количества HBr, растворенного в воде.
Точка плавления
-11ºC (12ºF, 393ºK) (водный раствор при 49% мас. / Мас.).
Точка кипения
122 ° С (252 ° F, 393 ° К) при 700 мм рт. Ст. (Водный раствор 47-49% мас. / Мас.).
Растворимость в воде
-221 г / 100 мл (при 0 ºC).
-204 г / 100 мл (15 ºC).
-130 г / 100 мл (100 ºC).
Эти значения относятся к газообразному HBr, а не к бромистоводородной кислоте. Как видно, повышение температуры снижает растворимость HBr; поведение, которое является естественным в газах. Следовательно, если требуются концентрированные растворы HBr (ac), лучше работать с ними при низких температурах..
При работе при высоких температурах HBr будет выходить в виде газообразных двухатомных молекул, поэтому реактор должен быть герметично закрыт для предотвращения утечки.
Плотность пара
2,71 (по отношению к воздуху = 1).
Кислотность пКа
-9,0. Эта константа, столь отрицательная, свидетельствует о ее сильной кислотности.
Калорийность
Стандартная молярная энтальпия
198,7 кДж / моль (298 ºK).
Стандартная молярная энтропия
Точка зажигания
номенклатура
В то время как HBr (г), бромистый водород, является безводным; то есть у него нет воды. Поэтому он назван в соответствии с другими стандартами номенклатуры, что соответствует галогеноводородам.
Как это формируется?
Существует несколько синтетических методов приготовления бромистоводородной кислоты. Некоторые из них:
Смесь водорода и брома в воде
Без описания технических подробностей эту кислоту можно получить из прямой смеси водорода и брома в реакторе, заполненном водой..
Фосфор трибромид
В более сложном процессе смешивают песок, гидратированный красный фосфор и бром. Водяные ловушки помещаются в ледяные ванны, чтобы предотвратить выход HBr и образование вместо него бромистоводородной кислоты. Реакции:
Диоксид серы и брома
Это окислительно-восстановительная реакция. Br2 он уменьшает, он получает электроны, связываясь с атомами водорода; в то время как ТАК2 он окисляется, он теряет электроны, когда он образует больше ковалентных связей с другими атомами кислорода, как в серной кислоте.
приложений
Приготовление бромидов
Бромидные соли могут быть получены, если HBr (ac) реагирует с гидроксидом металла. Например, производство бромида кальция считается:
Другой пример для бромида натрия:
NaOH + HBr => NaBr + H2О
Таким образом, многие из неорганических бромидов могут быть получены.
Синтез алкилгалогенидов
А как насчет органических бромидов? Это броморганические соединения: RBr или ArBr.
Обезвоживание спиртов
Сырьем для их получения могут быть спирты. При протонировании кислотностью HBr они образуют воду, которая является хорошей исходящей группой, и вместо этого включается объемный атом Br, который становится ковалентно связанным с углеродом:
ROH + HBr => RBr + H2О
Добавление к алкенам и алкинам
Молекула HBr может быть добавлена из ее водного раствора к двойной или тройной связи алкена или алкина:
RC≡CR + HBr => RHC = CRBr
Можно получить несколько продуктов, но в простых условиях продукт сначала образуется там, где бром связан с вторичным, третичным или четвертичным углеродом (правило Марковникова)..
Эти галогениды вмешиваются в синтез других органических соединений, и диапазон их применения очень широк. Кроме того, некоторые из них могут даже использоваться в синтезе или разработке новых лекарств..
Эфирный кливаж
Из простых эфиров можно получить два алкилгалогенида одновременно, каждый из которых несет одну из двух боковых цепей R или R ‘исходного эфира R-O-R’. Случается что-то похожее на обезвоживание спиртов, но механизм его реакции другой.
Реакция может быть схематизирована с помощью следующего химического уравнения:
ROR ‘+ 2HBr => RBr + R’Br
И вода тоже выделяется.
катализатор
814 частей на миллион (мышь, 1 час)
Бромистый водород и его водный раствор являются обычно используемыми реагентами для получения бромидных соединений.
СОДЕРЖАНИЕ
Реакции
Органическая химия
HBr + CH 2 Cl 2 → HCl + CH 2 BrCl HBr + CH 2 BrCl → HCl + CH 2 Br 2
Эти реакции метатезиса иллюстрируют потребление более сильной кислоты (HBr) и высвобождение более слабой кислоты (HCl).
RC≡CH + HBr → RC (Br) = CH 2
Неорганическая химия
2 VCl 4 + 8 HBr → 2 VBr 3 + 8 HCl + Br 2
Промышленная подготовка
Лабораторный синтез
HBr может быть получен перегонкой раствора бромида натрия или бромида калия с фосфорной или серной кислотой :
Концентрированная серная кислота менее эффективна, поскольку окисляет HBr до брома :
Кислота может быть получена:
Безопасность
HBr вызывает сильную коррозию и раздражает при вдыхании.
Бромоводород
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.














