hydrogen peroxide что это такое
Пероксид водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Плотность | 1.4 г/см³ |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия образования (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная |
| Классификация | |
| Рег. номер CAS | 7722-84-1 |
| SMILES | OO |
| Регистрационный номер EC | 231-765-0 |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
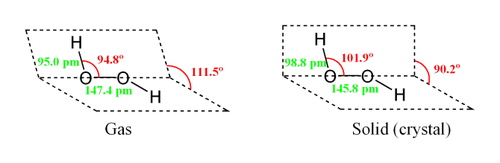
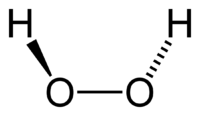
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Содержание
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обуславливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:

При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10 −12 ), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):

Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
В реакции с нитритом калия соединение служит окислителем:
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако, несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В промышленных масштабах пероксид водорода получают электролизом серной кислоты, в ходе которого образуется надсерная кислота, и последующим разложением последней до пероксида и серной кислоты.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяется для небольших поверхностных ран, исследования показали что этот метод обеспечивая антисептический эффект и очищение и удлиняет время заживления. [1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, получившихся при взаимодействии перманганата калия «марганцовки» с предметами (ввиду его окислительных свойств).
Пероксид водорода в аквариумистике
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме (гидры, планарии, паразиты, водоросли, бактерии и др.)
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл. [7]
Пероксид водорода
Из Википедии — свободной энциклопедии
наименование
(при 20 °C)

Перокси́д водоро́да (пе́рекись водоро́да), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Перекись водорода (Hydrogen peroxide)
Химические свойства перекиси и ее применение
Перекись водорода — сильный окислитель, который состоит из 2 частей кислорода и 2 частей водорода. Она нестабильна, и под действием света, тепла или в присутствии металлов распадается с образованием воды и активного кислорода. Активный кислород при этом может взаимодействовать с окружающими веществами и окислять их. В результате окисления образуются просто молекулы газообразного кислорода, что вызывает вспенивание. Поэтому данный компонент может использоваться как пенообразователь. Кроме этого при окислении выделяется тепло, что широко используется в парикмахерских в зимнее время: окрашивающий состав просто покрывают шапочкой, чтобы реакция не останавливалась.
Химическая формула перекиси водорода
Перекись широко используют в быту, промышленности, косметике и медицине.
В промышленности она используется в качестве пенообразователей при производстве пористых материалов. Как окислитель она нашла широкое применение при производстве дезинфицирующих и отбеливающих средств.
В медицине 2,5-3% раствор перекиси водорода часто используется как антисептическое средство. При контакте с поврежденной кожей и слизистыми, перекись распадается с выделением кислорода, что способствует свертываемости (окислению) крови, а также создает неблагоприятные условия для развития микроорганизмов. Однако стоит отметить, что использование перекиси водорода на ранах для уменьшения бактериальной инфекции малоэффективно и ведутся активные споры о целесообразности ее применения в этих целях.
Инфографика о применении Hydrogen peroxide
Также Hydrogen peroxide можно обнаружить в составах капель для ушей (это один из компонентов который помогает в удалении ушной серы).
В пищевой промышленности перекись водорода используется для дезинфекции оборудования, соприкасающегося с продукцией, а также для дезинфекции пищевой упаковки по технологии «Тетра Пак». А так же окислительные свойства перекиси приносят пользу при осветления молока, сырных продуктов, вина, уксуса, крахмала и т.п.
Применение Hydrogen peroxide в косметике
Наиболее часто в косметике используется перекись водорода для окрашивания и осветления волос, но также она используется в средствах для полости рта, кожи и для отбеливания зубов.
Средства для кожи
Перекись водорода могут применять для осветления кожи и прыщей. Активный кислород реагирует с пигментами кожи и делает ее светлее, способствует очищению и удаляет омертвевшие клетки. Однако помимо этого активный кислород может вызвать раздражение кожи, особенно, если она сухая и чувствительная. Поэтому его рекомендуют использовать только после консультации с врачом.
Перекись водорода в косметике для для кожи
Средства для волос
В косметике для волос перекись работает как окислитель. Образовавшийся при ее распаде активный кислород взаимодействует:
Перекись входит в состав готовых продуктов:
Hydrogen peroxide в средствах для волос
В описанных выше продуктах для более надежного хранения состава в течении всего срока годности перекись дополнительно:
В таком варианте и без прямых солнечных лучей или нагревания составы действительно стабильны и не реагируют внутри упаковки. Однако, стоит нарушить технологию хранения или транспортировки — сразу перекись начинает распадаться прямо в бутылке и может даже взорваться (но это бывает не часто). Чаще же бутылку не разрывает полностью, а она начинают потихоньку протекать без видимых на первый взгляд причин. На самом же деле давление внутри закрытой упаковке вызывает образование дырочек в самых слабых местах шва бутылки и через них начинает протекать состав.
Максимальная концентрация перекиси, которая использовалась в продуктах для волос на данный момент — 15% (причем это были профессиональные продукты, которые очень редки на рынке). Для непрофессиональных красок встречались окислители с 12,4%, но это тоже редкий вариант. Стандартом считаются составы с 12%, 9%, 6% и 3% и менее перекиси водорода.
Средства для отбеливания зубов и гигиены полости рта
Тут тоже в основном используются окислительные свойства. Образовавшийся при распаде перекиси активный кислород окисляет зубной налет и тем самым облегчает очистку зубов. Однако в этом случае при концентрациях свыше 0,1% осветление идет с небольшим разрушением тканей. Поэтому данные средства во избежании вреда не используют до или сразу после реставрации зубов, и зачастую перед применением рекомендуется консультация стоматолога.
Составы для зубов
Уход за ногтями
В средствах для ногтей перекись является одним из активных компонентов для борьбы с грибком, а также помогает в осветлении желтых ногтей.
Пара слов о безопасности перекиси водорода
Американское управление контроля пищевых продуктов и медикаментов (FDA) включило данный компонент в список веществ, которые точно являются безопасными для использования в пище, что позволило его использовать в пищевой промышленности. Кроме этого данный компонент включен в списки безрецептурных антисептиков, а также безрецептурных очищающих средств для ран слизистой оболочки полости рта. Международное агентство по исследованию рака пришло к выводу, что перекись не является канцерогенным веществом.
Пероксид водорода
Допустимые концентрации
В ЕС Hydrogen peroxide может использоваться в средствах по уходу за волосами, кожей, ногтями и в средствах для гигиены полости рта в следующих максимальных концентрациях:
Однако при этом все эти средства должны иметь специальную маркировку о присутствии перекиси в составе и предупреждение об опасности контакта с глазами.
Отдельно научный комитет Европейской комиссии по потребительским продуктам оценил безопасность Hydrogen peroxide в продуктах для отбеливания зубов и пришел к выводу, что продукты, которые содержат до 1% перекиси являются безопасными для самостоятельного применения (однако все же рекомендуется проконсультироваться с врачом), а составы с концентрацией 6% можно использовать только после консультации стоматолога.
Hydrogen peroxide что это такое
Необходимо купить лекарство в Европе?
Это возможно!
Необходимо купить лекарство в Европе?
Это возможно!
Необходимо купить лекарство в Европе?
Это возможно!
\ По этому рецепту Вы или Ваш представитель можете самостоятельно купить это лекарство в аптеках стран Евросоюза или заказать услугу по выкупу и отправке в Россию из
\ Финляндии на сайте посреднической финской компании http://nilsi.eu/.
\ Не забывайте самостоятельно проверять списки лекарств, запрещенных к ввозу в Вашу страну!’; let med_html = first_line + ‘ \
\ По этому рецепту Вы или Ваш представитель можете самостоятельно купить это лекарство в аптеках стран Евросоюза или заказать услугу по выкупу и отправке в Россию из
\ Финляндии на сайте посреднической финской компании http://nilsi.eu/.
\ Не забывайте самостоятельно проверять списки лекарств, запрещенных к ввозу в Вашу страну!’; let index_html = first_line_ver3 + ‘ \
\ По этому рецепту Вы или Ваш представитель можете самостоятельно купить это лекарство в аптеках стран Евросоюза или заказать услугу по выкупу и отправке в Россию из
\ Финляндии на сайте посреднической финской компании http://nilsi.eu/.
Бесцветная прозрачная жидкость без запаха.
воспалительные заболевания слизистых оболочек;
капиллярное кровотечение из поверхностных ран;
для дезинфекции и дезодорирования: стоматит, ангина, тонзиллит, гинекологические заболевания.
Для наружного применения используют 1–3% раствор, для полоскания полости рта и горла, нанесения на слизистые оболочки — 0,25 % раствор (3% раствор разводят водой в соотношении 1:11).
Поврежденные участки кожи или слизистой оболочки обрабатывают ватным или марлевым тампоном, смоченным раствором препарата. Тампоны следует держать пинцетом. Возможно струйное орошение раневой поверхности.
Гиперчувствительность к компонентам препарата.
С осторожностью: декомпенсированные заболевания печени и почек, гипертиреоз, герпетиформный дерматит.
Жжение в момент обработки раны, аллергические реакции.
Симптомы: раздражение верхних дыхательных путей (ожог, ларинго-, бронхоспазм); при попадании внутрь — раздражение слизистых оболочек ЖКТ, гемолиз, гемоглобинурия; летальная доза — около 3 г.
Лечение: промывание желудка 0,5% раствором натрия тиосульфата, раствором натрия гидрокарбоната, в/в введение натрия тиосульфата 30% — до 300 мл.
Антисептическое средство из группы антиоксидантов. При контакте перекиси водорода с поврежденной кожей или слизистыми оболочками высвобождается активный кислород, при этом происходит механическое очищение и инактивация органических веществ (протеины, кровь, гной). Антисептическое действие не является стерилизующим, при его применении происходит лишь временное уменьшение количества микроорганизмов. Обильное пенообразование способствует тромбообразованию и остановке кровотечения из мелких сосудов.
Раствор перекиси водорода нестабилен в щелочной среде, в присутствии солей металлов, сложных радикалов некоторых оксидантов, а также на свету и в тепле.
Хранить в недоступном для детей месте.
Срок годности препарата Перекись водорода2 года.
Не применять по истечении срока годности, указанного на упаковке.
| Раствор для местного и наружного применения 3% | 100 мл |
| активное вещество: | |
| перекись водорода медицинская | от 7,5 до 11 г |
| в зависимости от фактического содержания водорода пероксида в исходной субстанции эквивалентно содержанию водорода пероксида 3 г (от 30 до 40%) | |
| вспомогательные вещества: натрия бензоат — 0,05 г; вода очищенная — до 100 мл |
Форма выпуска
Раствор для местного и наружного применения 3%.
По 40, 100 мл во флаконах из стекла или во флаконах-капельницах из стекла с винтовой горловиной, укупоренных пробками ПЭ и крышками навинчиваемыми или крышками с прокладками.
По 40, 100 мл в бутылках для ЛС из ПЭ высокого или низкого давления, укупоренных навинчиваемыми пластмассовыми крышками с прокладками или со специальной насадкой.
Каждый флакон, флакон-капельницу помещают в пачку из картона.
Допускается флаконы стеклянные по 40 и 100 мл упаковывать в коробки из картона с перегородками или решетками из картона гофрированного.
Допускается флаконы из ПЭ по 40 и 100 мл упаковывать в пленку ПЭ термоусадочную или в коробки из картона.
По 500, 1000 мл во флаконах, укупоренных навинчиваемыми пластмассовыми крышками с прокладками (для стационара).
По 12 фл. по 500 мл, по 8 фл. по 1000 мл упаковывают в пленку ПЭ термоусадочную или в коробки из гофрокартона (для стационара).
Препарат не имеет противопоказаний для применения во время беременности и в период лактации.
Не рекомендуется использовать препарат под окклюзионные повязки. Следует избегать попадания в глаза! Не применять для орошения полостей!
Обработка раны раствором перекиси водорода не гарантирует от заражения столбняком и другой раневой инфекцией.
3% раствор применяют внутрь в токсикологической практике в качестве антидота (в комбинации с 3% раствором уксусной кислоты) при отравлении калия перманганатом.
Влияние на способность управлять транспортными средствами и механизмами. Не влияет.
При уничтожении неиспользованного препарата специальных мер предосторожности не требуется.