Легкая рестрикция что это
Центр неврологии в Москве
(495) 506 61 01
Обструктивные и рестриктивные заболевания легких
Обструктивные заболевания легких
Обструктивные заболевания легких включают состояния, которые затрудняют выдох и дыхание в целом. Главный симптом обструктивного заболевания легких – постоянно преследующая одышка.
Люди с обструктивной болезнью легких страдают из-за одышки, из-за того, что им трудно выдыхать воздух, скопившийся в легких. Выдыхаемый воздух выходит медленнее, что связано с повреждением легких или сужением дыхательных путей. Воздух может задерживаться в легких в конце полного выдоха.
Обструкция легких сопровождается сухим кашлем (или влажным кашлем с небольшим количеством белой мокроты), гипоксией. В тяжелых случаях человек чувствует, что задыхается. Бронхобструкция является обратимой, чтобы снять приступ, необходимо вдыхание лекарственных веществ через ингалятор. Обычно при тяжелом приступе обструкции люди вызывают Скорую помощь. Тогда приехавшие специалисты вводят внутримышечно кортикостероидные препараты, чтобы снять приступ.
Для лечения легочной обструкции можно обратиться в терапевтическое отделение Юсуповской больницы. В нем работают опытные пульмонологи.
Наиболее распространенными причинами обструктивного заболевания легких являются:
Обструктивная болезнь легких затрудняет дыхание, особенно при повышенной физической нагрузке. По мере того, как скорость дыхания увеличивается, у вас есть меньше времени, чтобы выдохнуть весь воздух до следующего вдоха.
Рестриктивные заболевания легких
Рестриктивные заболевания легких приводят к уменьшению объемов легких, а также к поражению плевры, грудной стенки, диафрагмы и нарушению нервно-мышечной передачи. Рестриктивные болезни легких могут быть острые и хронические.
Люди с рестриктивным заболеванием легких не могут полностью заполнить свои легкие воздухом. Их легкие полностью не расширяются.
Состояния, вызывающие рестриктивное заболевание легких, следующие:
Симптомы обструктивной и рестриктивной болезни легких
Обструктивная болезнь легких и рестриктивное заболевание легких вызывают одышку. На ранних стадиях обструктивного или рестриктивного заболевания легких одышка происходит только при физическом напряжении.
Если болезнь легких прогрессирует, одышка может возникать при минимальной активности или даже в состоянии покоя. Кашель является распространенным симптомом при рестриктивных и обструктивных заболеваниях легких. Как правило, кашель сухой или производительный, те влажный, с выделением белой мокроты.
Симптомы депрессии и тревоги также распространены среди людей с обструктивным и рестриктивным заболеваниями легких. Эти симптомы возникают чаще, когда заболевание легких вызывает значительные ограничения в активности и образе жизни.
Диагностика обструктивной и рестриктивной болезни легких
Чаще всего люди с обструктивной или рестриктивной болезнью легких обращаются к врачу, потому что им не хватает дыхания, возникает одышка.
Рестриктивные и обструктивные заболевания легких выявляются с помощью легочных функциональных тестов. Когда человек выполняет различные дыхательные маневры, машина регистрирует объем и поток воздуха через легкие. Тестирование функции легких может выявить наличие обструктивной болезни легких или рестриктивного заболевания легких, а также определить их тяжесть.
Анкетирование врачом (включая историю курения), физический осмотр и лабораторные тесты могут дать дополнительные сведения о причине обструктивного заболевания легких или рестриктивных заболеваний легких.
Все необходимые диагностические мероприятия проводятся квалифицированными пульмонологами в терапевтическом отделении Юсуповской больницы.
Испытания на визуализацию почти всегда являются частью диагностики рестриктивной и обструктивной болезни легких. Они могут включать такие исследования, как:
У некоторых людей при обструктивной болезни легких может быть рекомендована бронхоскопия. При бронхоскопии врач использует эндоскоп (гибкую трубку с камерой и инструменты на ее кончике), чтобы заглянуть внутрь дыхательных путей и взять образцы легочной ткани (биопсия).
Что такое ХОБЛ?
Термин ХОБЛ – хроническая обструктивная болезнь легких применяется к целому ряду заболеваний легких, которые характеризуются нарушением способности выдыхать воздух из легких. Легочную функцию можно измерить с помощью пикфлоуметра.
Основными заболеваниями, включенными в эту группу, являются хронический бронхит, эмфизема а иногда и астма с постоянным течением. ХОБЛ является основной причиной серьезных заболеваний в России, и более 15 миллионов страдают это й болезнью. Курение сигарет составляет 80-90% риска развития ХОБЛ, хотя очень небольшое число пациентов имеют генетическую форму эмфиземы, провоцируемую альфа-1-антитрипсином.
Менее четко определенные генетические и экологические факторы, вероятно, также определяют вероятность человека заболеть хронической обструктивной болезнью легких. Эмфизема легких является хроническим тяжелым заболеванием нижних дыхательных путей. При эмфиземе легких альвеолы разрушаются, суживаются или заполняются жидкостью. Это снижает респираторную функцию, появляется одышка. При повреждении воздушных мешочков появляются в легочной ткани постоянные «отверстия», данное состояние является необратимым.
Что делать, если у меня ХОБЛ?
Хотя многие признаки ХОБЛ являются необратимыми, пациенту можно существенно помочь при помощи методик медикаментозного лечения и реабилитации. Небольшое число пациентов с тяжелой ХОБЛ могут быть кандидатами на хирургическое лечение (операция по трансплантации легких). Ваш врач может сообщить вам более подробно обо всех этих вариантах.
Что такое астма?
Одной из задач реабилитации при хронической обструктивной болезни легких является помощь пациенту в достижении независимости, стремление к улучшению общего качества его жизни – ее физической, эмоциональной и социальной составляющей.
Достижение этих целей помогает людям с ХОБЛ жить более комфортно, быть более выносливыми. Лечение и реабилитация облегчают симптомы и предотвращают прогрессирование заболевания с минимальными побочными эффектами.
Важно распознавать и лечить даже симптомы легкой астмы, чтобы избежать более серьезного эпизода. Ключом к контролю над вашей астмой является раннее распознавание предупреждающих знаков. Это признаки, предупреждающие, что ваша астма становится все хуже. Затем вы должны знать, как вернуть свою астму под контроль, используя план контроля астмы.
Методы лечения обструкции легких
При обструкции легких происходит воспаление и сужение бронхов. Это запускает тяжелый патологический процесс в легких. Заболевание склонно прогрессировать и протекать хронически. На слизистой оболочке воздушных путей есть так называемые ворсинки. Они задерживают вирусы и вредные вещества, попадающие в организм. Если на бронхи оказывается негативное воздействие, снижаются защитные функции бронхов. Плохо влиять на легкие могут частички сажи, сигаретный дым, токсичные вещества, пыль.
Особенно бронхобструкции подвержены аллергики. При снижении защитной функции бронхов развивается воспалительный процесс. Последствием воспаления является отек слизистой оболочки, сужение бронхиального прохода. Это провоцирует затруднения в дыхании. При выслушивании (аускультации легких) слышны хрипящие и свистящие звуки.
В тяжелых случаях хронической обструктивной болезни легких может потребоваться дополнительная кислородная терапия. Механическая помощь при дыхании может быть полезна некоторым людям с затрудненным дыханием, связанным с рестриктивным заболеванием легких.
В случаях заболевания легких, связанного с ожирением, потеря веса и физические упражнения могут помочь уменьшить расстройства дыхания, вызванные избыточным содержанием жира.
Тяжелые, конечные стадии рестриктивного заболевания легких (такие как идиопатический легочный фиброз) могут лечиться трансплантацией легких. Широкий спектр методов лечения обструктивной болезни легких применяется в терапевтическом отделении Юсуповской больницы. С больными с легочными заболеваниями работают опытные пульмонологи.
Рестриктивные нарушения дыхания на фоне постторакотомического болевого синдрома как фактор риска развития внутрибольничной пневмонии
В.Э. Хороненко, Д.С. Баскаков, А.С. Маланова, Е.А. Мандрыка, М.М. Шеметова
Для корреспонденции: Маланова Анна Сергеевна, канд. мед. наук, младший научный сотрудник отдела анестезиологии и реанимации МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва; e-mail: malanova_anna@mail.ru
Для цитирования: Хороненко В.Э., Баскаков Д.С., Маланова А.С., Мандрыка Е.А., Шеметова М.М. Рестриктивные нарушения дыхания на фоне постторакотомического болевого синдрома как фактор риска развития внутрибольничной пневмонии. Вестник интенсивной терапии имени А.И. Салтанова. 2019;1:78–84. DOI: 10.21320/1818-474X-2019-1-78-84
Реферат
Обоснование. Болевой синдром является наиболее частым осложнением торакотомии. Он не только причиняет дискомфорт больным, но и может стать причиной нарушения дыхательной функции.
Цель исследования. Анализ влияния постторакотомического болевого синдрома (ПТБС) на функцию внешнего дыхания онкологических пациентов, перенесших открытые оперативные вмешательства на легких.
Материалы и методы. В исследование включены 300 пациентов, которым выполнены обширные онкологические оперативные вмешательства по поводу злокачественных новообразований легких. В зависимости от варианта анестезиологического пособия все исследуемые были рандомизированы на 3 сопоставимые группы: грудная эпидуральная анальгезия (ГЭА), n = 100; паравертебральная блокада (ПВБ), n = 100; межреберная блокада (МРБ) n = 100. На 3-и сутки после операции осуществлялась оценка интенсивности болевого синдрома по визуально-аналоговой шкале (ВАШ) и выполнялась спирометрия.
Результаты. Анализ интенсивности послеоперационного болевого синдрома показал превосходство эпидуральной анальгезии над другими методиками. У пациентов с болевым синдромом интенсивностью более 30 мм ВАШ показатели объема форсированного выдоха за 1 с (ОФВ1), жизненной емкости легких (ЖЕЛ) и экскурсии грудной клетки были значительно ниже, чем у больных с болевым синдромом до 30 мм ВАШ. Развитие болевого синдрома более 70 мм ВАШ приводило к значимому ухудшению показателей ЖЕЛ и экскурсии грудной клетки относительно больных с ПТБС 31–70 мм ВАШ, что увеличивало риск инфекционных осложнений.
Заключение. Обеспечение оптимальной антиноцицептивной защиты в периоперационный период обеспечивает лучшие показатели функции внешнего дыхания и тем самым способствует снижению частоты бронхопульмональных осложнений. Методом выбора в торакальной хирургии является сочетанная общая анестезия с высокой грудной эпидуральной блокадой.
Ключевые слова: онкохирургия, постторакотомический болевой синдром, эпидуральная анестезия, паравертебральная блокада, межреберная блокада
Поступила: 15.11.2018
Принята к печати: 01.03.2019
Введение
Болевой синдром является наиболее частым осложнением торакотомии, причиняющим дискомфорт больным в период после операции и вызывающим беспокойство не только у пациентов, но и у хирургов и анестезиологов-реаниматологов во всем мире [1]. Несмотря на все большее расширение знаний в области патофизиологии и фармакологии ноцицепции, постторакотомической болевой синдром (ПТБС) продолжает оставаться серьезной проблемой послеоперационного периода. Он способен привести к нарушению нормальной биомеханики дыхания, гормональным и иммунным изменениям [2, 3]. Ограниченная подвижность грудной стенки, в свою очередь, способна привести к нарушению дренажной функции бронхов, формированию участков ателектазирования в легких и, как следствие, присоединению воспалительных осложнений в послеоперационный период [4].
Возможные источники болевой импульсации после торакальной хирургии многочисленны и включают в себя хирургический разрез, повреждение или раздражение межреберных нервов, воспаление в стенке грудной клетки, паренхимы легких и плевры. Присоединение нейропатического компонента боли на ранних этапах послеоперационного периода обусловливает развитие труднокупируемого болевого синдрома [5].
В последние годы для решения проблемы ПТБС использовались разнообразные подходы [6]. Были исследованы различные методики анестезии, проведена сравнительная оценка эффективности высокой грудной анестезии/анальгезии и паравертебральных блокад, межреберных и внутриплевральных блокад [7]. Изучен мультимодальный подход с комбинированным использованием опиоидов, региональных методов обезболивания и других системных противовоспалительных лекарственных средств [8]. Основным направлением для исследования в подобных работах являлась оценка интенсивности болевого синдрома в условиях использования того или иного метода анестезии и анальгезии. Изменения биомеханики дыхания, связанные с болевым синдромом, и развитие на этом фоне респираторных осложнений в большинстве работ не изучались достаточно подробно.
Таким образом, на сегодняшний день представляет определенный интерес оценка влияния ПТБС на показатели функции внешнего дыхания и, как следствие, на частоту развития послеоперационных респираторных инфекций. Особенно актуально данная проблема стоит в хирургии рака легкого [9]. Это обусловлено большим травматизмом онкохирургических вмешательств, значительной коморбидностью пациентов, необходимостью быстрой реабилитации для начала следующего этапа противоопухолевого лечения. Целью нашего исследования являлось определение значимости нарушений функции внешнего дыхания на фоне ПТБС для формирования послеоперационных внутрибольничных респираторных осложнений.
Методы исследования
В исследование включены 300 пациентов (203 мужчин, 97 женщин) в возрасте от 45 до 70 лет (средний возраст 57,87 ± 8,96 года), которым в условиях МНИОИ им. П.А. Герцена в период с 2014 по 2017 г. выполнены обширные онкологические оперативные вмешательства по поводу злокачественных новообразований легких преимущественно II–III стадии или метастазов в легкие опухолей различных локализаций.
Критериями включения в исследование являлись:
В зависимости от варианта анестезиологического пособия все исследуемые были рандомизированы на 3 сопоставимые группы: грудная эпидуральная анальгезия (ГЭА), n = 100; паравертебральная блокада (ПВБ), n = 100; межреберная блокада (МРБ), n = 100.
Пациентам всех групп за сутки до операции назначали антиконвульсант прегабалин 75 мг 2 раза в сутки per os. На ночь перед операцией пациенты получали диазепам 10 мг в/м. За 2 ч до операции больные принимали внутрь утреннюю дозу прегабалина (75 мг). Затем пациентам согласно программе рандомизации осуществлялся определенный вид анестезии. В группе ГЭА (n = 100) катетеризацию эпидурального пространства проводили на уровне Th4–Th6, с последующим проведением катетера в краниальном направлении на 4 см, затем выполнялась инфузия модифицированной смеси Бревика (ропивакаин 3 мкг/мл + фентанил 4 мкг/мл + адреналин 2 мкг/мл) со скоростью 5–15 мл/ч в течение операции. В послеоперационном периоде 1–2 сутки продолжалась дотация смеси Бревика, далее в профильном отделении переходили на 0,2% раствор наропина со скоростью 4–6 мл/ч в течение 5 суток. В группе ПВБ (n = 100) катетеризацию паравертебрального пространства (ПВП) производили с унилатеральной стороны под контролем УЗИ навигации, под местной инфильтрационной анестезией на уровне Th5–Th6 с установкой катетера. До операции в ПВП вводили: лидокаин 2% — 10 мл и смесь 0,3% раствора ропивакаина, фентанила (4 мкг/мл) и адреналина (2 мкг/мл) — 20 мл. В конце операции также болюсно вводили модифицированную смесь Бревика. В послеоперационный период пациенты получали в ПВП модифицированную смесь Бревика в течение 1–2 суток, со скоростью от 8 до 12 мл/ч, с 3-х суток: ропивакаин 0,2% со скоростью 8–12 мл/ч в течение 5 суток. В группе МРБ (n = 100) хирургической бригадой после удаления препарата и выполнения лимфаденэктомии пункционной иглой производилась блокада межреберья, через которое осуществлялся хирургический доступ, а также на одно межреберье выше и ниже. Вводили 30 мл 96% этилового спирта + 30 мл 0,5% раствора новокаина. В послеоперационном периоде при ярко выраженном болевом синдроме проводилось дополнительное введение местного анестетика (новокаина 0,5%) чрескожно.
Интраоперационно осуществлялся стандартный мониторинг показателей гемодинамики (АД, Ps, SaO2, ЭКГ), уровня анестезии (энтропия), нейромышечной проводимости (TOF watch).
Для оценки интенсивности ПТБС использовалась 100-миллиметровая ВАШ. Пациентам предлагалось оценить интенсивность боли на 3-и сутки после операции, выставив специальный бегунок в определенной точке шкалы. Оценивалась только интенсивность болевого синдрома при движении — максимально глубокий вдох, кашель. Расстоянию в миллиметрах от начала шкалы соответствовала интенсивность боли в баллах, крайние точки шкалы были определены как «нет боли» и «настолько сильно болит, насколько это возможно себе представить». Болевой синдром 1–30 мм по ВАШ считался легким, 31–70 мм — умеренным, более 70 мм — тяжелым [10–12].
Оценку функции внешнего дыхания (показатели- ЖЕЛ, ОФВ1) осуществляли с помощью спирометра, а также производили измерения объема грудной клетки на вдохе и на выдохе с помощью сантиметровой ленты до и после операции, накануне операции и на 3-й день после операции.
Оценивали частоту жалоб пациентов на одышку или чувство нехватки воздуха в покое и потребность в выполнении фиброоптических санаций трахеобронхиального дерева в первые 3 суток после операции на основе показателей газообмена капиллярной крови. Особое внимание было уделено регистрации фактов развития внутрибольничных пневмоний за время пребывания пациентов в стационаре по данным рентгенографии легких.
Статистическую обработку данных проводили с помощью программы Statistica 6.0 for Windows (StatSoft Inc., USA), достоверность разницы относительных величин оценивали с помощью χ2 (хи-квадрат), достоверность отличий среди абсолютных величин определяли с помощью U-критерия Манна—Уитни. Разницу величин признавали достоверной при p 70 мм ВАШ) болевого синдрома приводило к значимому ухудшению показателей ЖЕЛ и экскурсии грудной клетки относительно больных с умеренно выраженным ПТБС (31–70 мм ВАШ).
| Таблица 3. Показатели функции внешнего дыхания в зависимости от интенсивности постторакотомического болевого синдрома | |||
| Интенсивность ПТБС (n = 300) | ОФВ1 (ЛЭ/ ПЭ) | ЖЕЛ (ЛЭ/ПЭ) | Экскурсия грудной клетки, см (ЛЭ/ПЭ) |
| 1–30 мм | 1,88 ± 0,6/ | 2,0 ± 0,6/ | 3,6 ± 1,4/ |
| (n = 138) | 1,65 ± 0,4 | 1,51 ± 0,3 | 2,8 ± 1,0 |
| 31–70 мм | 1,59 ± 0,4*/ | 1,72 ± 0,4*/ | 2,9 ± 1,2*/ |
| (n = 141) | 1,41 ± 0,4* | 1,45 ± 0,4 | 2,6 ± 1,0 |
| от 71 мм | 1,52 ± 0,8*/ | 1,48 ± 0,3* / | |
| (n = 21) | 1,16 ± 0,3* | 1,36 ± 0,3 | 1,8 ± 0,9* |
ЖЕЛ — жизненная емкость легких; ЛЭ — лобэктомия; ОФВ1 — объем форсированного выдоха за 1 с; ПТБС — постторакотомический болевой синдром; ПЭ — пневмонэктомия.
Дыхательная недостаточность ( Легочная недостаточность )
МКБ-10
Общие сведения
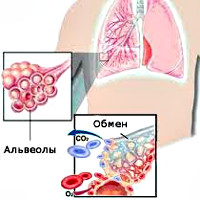
Внешнее дыхание поддерживает непрерывный газообмен в организме: поступление атмосферного кислорода и удаление углекислого газа. Любое нарушение функции внешнего дыхания приводит к нарушению газообмена между альвеолярным воздухом в легких и газовым составом крови. В результате этих нарушений в крови нарастает содержание углекислоты и уменьшается содержание кислорода, что ведет к кислородному голоданию, в первую очередь, жизненноважных органов – сердца и головного мозга.
При дыхательной недостаточности (ДН) не обеспечивается необходимый газовый состав крови, либо он поддерживается за счет перенапряжения компенсаторных возможностей системы внешнего дыхания. Угрожающее для организма состояние развивается при дыхательной недостаточности, характеризующейся снижением парциального давления кислорода в артериальной крови менее 60 мм рт. ст., а также повышением парциального давления углекислоты более 45 мм рт. ст.
Причины
Дыхательная недостаточность может развиваться при различных острых и хронических воспалительных заболеваниях, повреждениях, опухолевых поражениях органов дыхания; при патологии со стороны дыхательной мускулатуры и сердца; при состояниях, приводящих к ограничению подвижности грудной клетки. К нарушению легочной вентиляции и развитию дыхательной недостаточности могут приводить:
Классификация
Дыхательная недостаточность классифицируется по ряду признаков:
1. По патогенезу (механизму возникновения):
2. По этиологии (причинам):
3. По скорости нарастания признаков:
4. По показателям газового состава крови:
5. По степени выраженности симптомов ДН:
Симптомы дыхательной недостаточности
Признаки ДН зависят от причин ее возникновения, типа и тяжести. Классическими признаками дыхательной недостаточности служат:
Гипоксемия клинически проявляется цианозом (синюшностью), степень которого выражает тяжесть дыхательной недостаточности и наблюдается при снижении парциального давления кислорода (РаО2) в артериальной крови ниже 60 мм рт. ст. Для гипоксемии характерны также нарушения гемодинамики, выражающиеся в тахикардии и умеренной артериальной гипотонии. При понижении РаО2 в артериальной крови до 55 мм рт. ст. наблюдаются нарушения памяти на происходящие события, а при снижении РаО2 до 30 мм рт. ст. пациент теряет сознание. Хроническая гипоксемия проявляется легочной гипертензией.
Проявлениями гиперкапнии служат тахикардия, нарушения сна (бессонница ночью и сонливость днем), тошнота, головные боли. Быстрое нарастание в артериальной крови парциального давления углекислоты (РаСО2) может привести к состоянию гиперкапнической комы, связанной с усилением мозгового кровотока, повышением внутричерепного давления и развитием отека головного мозга. Синдром слабости и утомления дыхательных мышц характеризуется увеличением частоты дыхания (ЧД) и активным вовлечением в процесс дыхания вспомогательной мускулатуры (мышц верхних дыхательных путей, мышц шеи, брюшных мышц).
ЧД более 25 в мин. может служить начальным признаком утомления дыхательной мускулатуры. Урежение ЧД менее 12 в мин. может предвещать остановку дыхания. Крайним вариантом синдрома слабости и утомления дыхательной мускулатуры служит парадоксальное дыхание.
Одышка субъективно ощущается пациентами как нехватка воздуха при чрезмерных дыхательных усилиях. Одышка при дыхательной недостаточности может наблюдаться как при физическом напряжении, так и в спокойном состоянии. В поздних стадиях хронической дыхательной недостаточности с присоединением явлений сердечной недостаточности у пациентов могут появляться отеки.
Осложнения
Дыхательная недостаточность является неотложным, угрожающим для здоровья и жизни состоянием. При неоказании своевременного реанимационного пособия острая дыхательная недостаточность может привести к гибели пациента. Длительное течение и прогрессирование хронической дыхательной недостаточности приводит к развитию правожелудочковой сердечной недостаточности в результате дефицита снабжения сердечной мышцы кислородом и ее постоянных перегрузок. Альвеолярная гипоксия и неадекватная вентиляция легких при дыхательной недостаточности вызывает развитие легочной гипертензии. Гипертрофия правого желудочка и дальнейшее снижение его сократительной функции ведут к развитию легочного сердца, проявляющегося в застое кровообращения в сосудах большого круга.
Диагностика
На начальном диагностическом этапе тщательно собирается анамнез жизни и сопутствующих заболеваний с целью выявления возможных причин развития дыхательной недостаточности. При осмотре пациента обращается внимание на наличие цианоза кожных покровов, подсчитывается частота дыхательных движений, оценивается задействованность в дыхании вспомогательных групп мышц.
В дальнейшем проводятся функциональные пробы для исследования функции внешнего дыхания (спирометрия, пикфлоуметрия), позволяющая провести оценку вентиляционной способности легких. При этом измеряется жизненная емкость легких, минутный объем дыхания, скорость движения воздуха по различным отделам дыхательных путей при форсированном дыхании и т. д.
Обязательным диагностическим тестом при диагностике дыхательной недостаточности является лабораторный анализ газового состава крови, позволяющий определить степень насыщения артериальной крови кислородом и углекислым газом (PаО2 и PаСО2) и кислотно-щелочное состояние (КОС крови). При проведении рентгенографии легких выявляются поражения грудной клетки и паренхимы легких, сосудов, бронхов.
Лечение дыхательной недостаточности
Лечение пациентов с дыхательной недостаточностью предусматривает:
При выраженных признаках гипоксии в первую очередь проводится оксигенотерапия (кислородная терапия). Кислородные ингаляции подаются в концентрациях, обеспечивающих поддержание PаО2 = 55— 60 мм рт. ст., при тщательном мониторинге рН и PаСО2 крови, состояния пациента. При самостоятельном дыхании пациента кислород подается масочно или через носовой катетер, при коматозном состоянии проводится интубация и поддерживающая искусственная вентиляция легких.
Наряду с оксигнотерапией проводятся мероприятия, направленные на улучшение дренажной функции бронхов: назначаются антибактериальные препараты, бронхолитики, муколитики, массаж грудной клетки, ультразвуковые ингаляции, лечебная физкультура, проводится активная аспирация секрета бронхов через эндобронхоскоп. При дыхательной недостаточности, осложненной легочным сердцем, назначаются диуретики. Дальнейшее лечение дыхательной недостаточности направлено на устранение вызвавших ее причин.
Прогноз и профилактика
Дыхательная недостаточность является грозным осложнением многих заболеваний и нередко приводит к летальному исходу. При хронических обструктивных заболеваниях легких дыхательная недостаточность развивается у 30% пациентов.Прогностически неблагоприятно проявление дыхательной недостаточности у пациентов с прогрессирующими нейромышечными заболеваниями (БАС, миотония и др.). Без соответствующей терапии летальный исход может наступить в течение одного года.
При всех прочих патологиях, приводящих к развитию дыхательной недостаточности, прогноз разный, однако невозможно отрицать, что ДН является фактором, сокращающим продолжительность жизни пациентов. Предупреждение развития дыхательной недостаточности предусматривает исключение патогенетических и этиологических факторов риска.