Лейкотриены что это простыми словами
Лейкотриены
Лейкотрие́ны — группа липидных высокоактивных веществ, образующаяся в организме из арахидоновой кислоты, содержащей 20-членную углеродную цепь. Подкласс лейкотриенов, вместе с простаноидами, входит в класс эйкозаноидов. Один из основных эффектов лейкотриенов — бронхоспазм — лежит в основе патогенеза бронхиальной астмы.
Содержание
История
В 1938 году Киллвэй и Фелдберг, при исследовании воздействия яда кобры на лёгкие морских свинок, случайно обнаружили в лёгочном перфузате неизвестное ранее вещество, обладающее бронхоконстрикторным действием. Бронхоспазм, развивавшийся под воздействием этого неизвестного вещества, отличался от вызванной гистамином бронхоспастической реакции медленным развитием и большей продолжительностью. В связи с этим учёные назвали это вещество медленнореагирующей субстанцией анафилаксии (сокращенно МРСА, англ. slow reacting substance ).
В 1960 году Броклхёрст выделил МРС-А из лёгочной ткани больного бронхиальной астмой после проведения ингаляционной провокации с аллергеном. Этим исследованием он подтвердил, что МРСА обладает выраженным бронхоконстрикторным действием и является важным медиатором в развитии аллергического воспаления у больных БА.
В конце 1970-х годов была расшифрована структура молекулы МРСА. В исследованиях Бенгта Самуэльсона и его сотрудников было показано, что МРСА представляет собой неоднородную химическую структуру, относящуюся к семейству липидных медиаторов. Впервые эти медиаторы были выделены из лейкоцитов и характеризовались наличием конъюгированной триеновой структуры. В связи с этим выделенные вещества были названы «лейкотриенами» (ЛТ).
В настоящее время идентифицированы ЛТА4, ЛТВ4, ЛТС4, ЛТD4, ЛТE4, ЛТF4. Среди них выделяют 2 подгруппы лейкотриенов: к первой относят ЛТC4, ЛТD4, ЛТE4 и ЛТF4, они содержат в боковой цепи пептидные остатки, ко второй относят ЛТВ4, имеющий другое строение.
Синтез
Как было сказано выше, лейкотриены образуются из арахидоновой кислоты, которая, в свою очередь, отщепляется от фосфолипидов цитоплазматической мембраны, с помощью фермента фосфолипаза A2.
Далее арахидоновая кислота может трансформироваться двумя путями: под влиянием ЦОГ она превращается в простаноиды, а под влиянием липоксигеназной ферментной системы в лейкотриены.
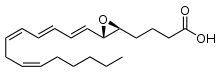
Липоксигеназная ферментная система относится к растворимым цитозольным ферментам, они обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах. Наиболее важным среди ферментов этой системы является 5-липоксигеназа (5-ЛОГ). Активация перечисленных клеток приводит к перемещению 5-ЛОГ к мембране ядерного аппарата и связыванию со специфическим белком — 5-ЛОГ-активирующим протеином (5-ЛОГ-АП). 5-ЛОГ-АП является кофактором при взаимодействии арахидоновой кислоты и 5-ЛОГ. Таким образом, арахидоновая кислота под воздействием комплекса 5-ЛОГ + 5-ЛОГ-АП превращается в нестабильное соединение 5-гидроксипероксиэйкозатетраеновую кислоту (5-HPETE), из которой в свою очередь образуется ЛТА4. Обе эти реакции катализируются активированной 5-ЛОГ, расположенной на перинуклеарной мембране.
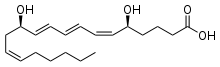
Далее ЛТА4 может превращаться двумя путями: либо при участии цитозольного фермента ЛТА4-гидролазы в ЛТВ4, либо под воздействием ЛТС4-синтетазы с образованием цисЛТС4. ЛТС4 выходит во внеклеточное пространство и далее с помощью g-глутамилтрансептидазы превращается в ЛТD4, который затем под влиянием дипептидазы образует ЛТЕ4. ЛТЕ4 является субстратом для образования ЛТF4.
Химическое строение
Известно 6 типов лейкотриенов — А, В, С, D, Е и F. Их объединяет — с точки зрения химического строения — наличие карбоксильной группы, общее число атомов углерода в основной цепочке (20) и наличие 4 двойных связей (поэтому после написания названия лейкотриена, указывают индекс 4). Тем не менее, каждая молекула лейкотриенов имеет свои особенности:
Таким образом, по химическому строению, можно выделить две группы лейкотриенов:
Роль в организме
Лейкотриеновые рецепторы
Выделяют три основных типа рецепторов лейкотриенов. [2] Причём два из них модулируются «пептидными лейкотриенами»:
Основные эффекты
Роль в патологии
Возможности фармакологической коррекции эффектов
Таким образом, можно выделить 4 точки приложения препаратов:
Лейкотриены что это простыми словами
История открытия лейкотриенов начинается в 1938 году, когда W. Feldberg и C.H. Kellaway занимались изучением влияния яда кобры на легкие морских свинок и обнаружили в перфузате легких вещество, способное вызывать медленное, стойкое сокращение гладких мышц. В 1940 г. C.H. Kellaway и E.R. Trethewie заметили, что это сокращение отличается по продолжительности от сокращения, вызываемого гистамином, и назвали новый медиатор медленно реагирующей субстанцией анафилаксии (МРС-А). В 1960 г. W. Brocklehurst заметил, что при добавлении аллергена к фрагментам легкого, взятых у больного бронхиальной астмой, в них вырабатывается МРСА. Это свидетельствует о том, что МРС-А – медиатор, отвечающий за симптоматику бронхиальной астмы, так как он вызывает более длительный бронхоспазм, чем другой бронхоконстриктор, например, гистамин. А в конце 70-х ученым удалось выяснить, что МРС-А является лейкотриенами. И после этого открытия учеными были предприняты попытки создания лекарств, являющихся ингибиторами синтеза и антагонистами лейкотриенов, которые используются при лечении бронхиальной астмы. [2]
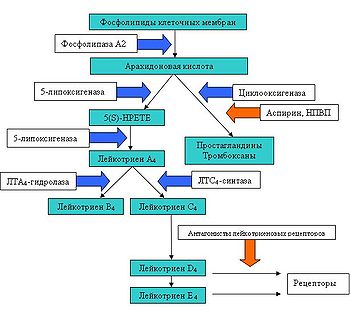
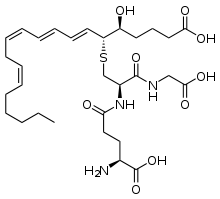
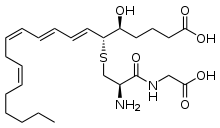
Синтез лейкотриенов – это сложный, многоступенчатый процесс, который начинается с отщепления арахидоновой кислоты от фосфолипидов цитоплазматической мембраны с помощью фермента фосфолипаза А2. Далее арахидоновая кислота может трансформироваться двумя путями: под влиянием циклооксигеназы она превращается в простагландины, а под влиянием липоксигеназной ферментной системы в лейкотриены. Липоксигеназная ферментная система относится к растворимым цитозольным ферментам, они обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах. Наиболее важным ферментом является 5-липоксигеназа (5-ЛОГ). Арахидоновая кислота под воздействием комплекса 5-ЛОГ превращается в оксиэйкозатетраеновые кислоты, из которой в свою очередь образуется LТА4. Во внутриклеточной среде к LТА4 под действием LТС4- синтазы присоединяется глутатион и образуется LТС4. Далее LТС4 выходит во внеклеточную среду, где от него отщепляется остаток глутаминовой кислоты и образуется лейкотриен D4. LТЕ4 образуется при отщеплении остатка глицина от LТD4. (рис.1) Лейкотриены С4, D4 и Е4 содержат цистеин, поэтому их называют цистеиновыми лейкотриенами. Именно цистеиниловые лейкотриены были названы МРС-А. Они имеют одно действие, но лейкотриен Е4 имеет меньшую активность. Ферментные системы, необходимые для синтеза лейкотриенов, были обнаружены в альвеолярных макрофагах, тучных клетках и лейкоцитах. А именно эозинофилы и тучные клетки являются основными эффекторами в патогенезе астмы. [4]
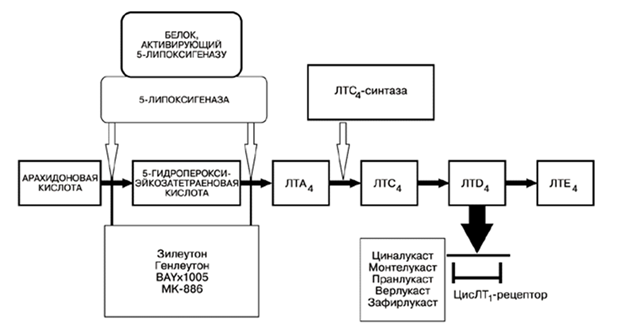
Рис. 1. Биосинтез цистеинил лейкотриенов.
Биологическое действие лейкотриенов опосредовано через рецепторы, которые относятся к группе пуриновых рецепторов, 7-кратно пронизывающих мембрану и связанных с G-белком. По специфическому связыванию с лигандами они делятся на 2 подкласса: связывающиеся с лейкотриеном B4, называемые BLT рецепторами, и цистеинил лейкотриеновые рецепторы – CysLTR. Эндогенными лигандами цистеинил лейкотриеновых рецепторов являются лейкотриены C4, D4 и E4.
Основное биологическое действие LTB4 заключается в стимуляции хемотаксиса, активации макрофагов и синтезе хемокинов и цитокинов. Считается, что он играет важную роль в формировании гнойного воспаления, ревматоидного артрита и других воспалительных заболеваниях. Однако его роль в патогенезе бронхиальной астмы не ясна, так как при использовании антагонистов рецепторов к LTB4 для лечения БА симптоматика не меняется.[5]
Выделяют две разновидности цистеинил лейкотриеновых рецепторов: CysLTR1 и CysLTR2. Эксперименты на мышах с дефицитом CysLTR2 или сверхэкспрессией CysLTR2 в легких показали, что CysLTR2 не способствуют бронхоспазму, а скорее способствуют воспалению, проницаемости сосудов и фиброзу тканей. Цистеиниловые лейкотриены повышают экспрессию таких молекул адгезии, как Р-селектин, который опосредует адгезию лейкоцитов к эндотелию сосудов в процессе острого воспаления. Модификаторы лейкотриенов могут снижать экспрессию цитокинов, блокируя их действия. Обратное явление также верно: цитокины могут модулировать экспрессию лейкотриенов. В целом цистеиниловые лейкотриены вызывают расширение периферических и сужение коронарных сосудов, увеличивают проницаемость бронхов, подавляют пролиферацию лимфоцитов и способствуют их дифференцировке. Ингаляции LTE4 увеличивают число эозинофилов в биоптате дыхательных путей, а ингаляции LTD4 повышают число эозинофилов в мокроте больных с бронхиальной астмой. Также именно этот комплекс ответственен за медленную фазу бронхоспазма при бронхиальной астме. [2,5]
Это объясняет усугубление астматических приступов у больных с непереносимостью нестероидных противовоспалительных препаратов (НПВП). У таких больных в бронхах увеличена экспрессия LTC4-синтазы, что приводит к увеличению продукции цистеиниллейкотриенов. Частичным объяснением этого явления может быть генетический полиморфизм гена LTC4-синтазы. Общий вариант промотора гена создает предрасположенность к аспириновой астме(АА) путем усиления эффекторного механизма бронхоконстрикции. Исследования с аспирином в сочетании с оценкой полиморфизма синтазы LTC 4 и экскреции LTC 4 с мочой указывают на некоторую гетерогенность среди пациентов с AA. Они тормозят образование простагландинов, высвобождая метаболический шунт арахидоновой кислоты в пользу лейкотриенов. Это проявляется в виде покраснений кожных покровов, приступов удушья и кашля, подъема температуры, конъюнктивита и отека Квинке. Степень аллергической реакции на НПВП зависит от антициклооксигеназной активности препарата и его количества. К препаратам с высокой антициклооксигеназной активностью относятся салицилаты (аспирин), полициклические кислоты (индометацин, толметин), ненасыщенные жирные кислоты (диклофенак, ибупрофен, кетопрофен, тиапрофеновая кислота), оксикамы (пироксикам, лорноксикам). [5]
Исходя из выше сказанного для лечения бронхиальной астмы, особенно у пациентов с непереносимостью НПВП, можно применять препараты, действующие на лейкотриеновую систему – антилейкотриены. С теоретической точки зрения, подавить активность лейкотриенов можно двумя путями: первый, это ингибировать их синтез, воздействуя на ферментную систему (в настоящее время удалось ингибировать только фермент 5-липоксигеназу), а второй это препятствовать связыванию лейкотриенов с их рецепторами. На рисунке 1 также показаны основные места действия различных антилейкотриенов. [4]
К первой группе этих препаратов относятся зилеутон (Zileuton) и генлеутон. Они явдяются антагонистами белка, активирующего 5-липоксигеназу. Ко второй антагонисты цистеинил лейкотриеновых рецепторов (CysLTR) – зафирлукаст (Zafirlucast), монтелукаст, циналукаст.
Зилеутон принимают перорально и он быстро всасывается. Жирная пища стимулирует его абсорбцию. При первом прохождении через печень из него образуются глюкурониды. Максимальная концентрация в крови наблюдается через 1,8-2,5 ч. Метаболиты выделяются почками. t
1-2,3 ч. Препарат рекомендован для применения взрослым. [3]
Результаты исследования A.R. Fischer et al. Показали, что прием Зилеутона не только уменьшает воспаление дыхательных путей, но и снижает их реактивность, то есть уменьшается степень и скорость сужения бронхов после контакта с бронхоконстрикторами. [7] Зилеутон помимо лечения бронхиальной астмы может использоваться и при ревматоидном артрите и язвенном колите. При применении Зилеутона возможны побочные эффекты: лихорадка, миалгия, утомляемость, головокружения, головная боль, диспепсия, повышение уровня трансаминаз и другие. [3]
Зафирлукаст избирательно и длительно блокирует рецепторы для LTE4 и LTD4 и обладает выраженным противовоспалительным действием. При бронхиальной астме это проявляется в виде уменьшения проницаемости сосудов, снижения отека слизистой, секреции густой мокроты, расширении бронхиол. Также было замечено, что зафирлукаст блокирует микросомальные ферменты, что сказывается на метаболизме и фармакокинетике других лекарств. Клинический эффект препарата развивается примерно через одни сутки, поэтому он используется для профилактики и длительного лечения бронхиальной астмы. Для купирования острых астматических приступов данный препарат не пригоден. Но он может использоваться в совокупности с быстродействующими антиастматическими лекарственными средствами. [6] Применение зафирлукаста может вызвать такие побочные действия, как головная боль, гастрит, фарингит, миалгия, артралгия и другие.
Препарат принимается перорально, хотя эффективен и при ингаляции. Максимальная концентрация определяется через 3 часа. Приимать следует натощак, так как наличие пищевых масс в кишечнике уменьшает всасывание на 40%. Через гематоэнцефалический барьер проникает плохо. Его метаболиты выделяются кишечником и почками, t
10 ч. Рекомендован для применения взрослым и детям старше 5 лет. [3]
Также к блокаторам антилейкотриеновых рецепторов относится Монтелукаст. Он является избирательным антагонистом LTD4, но в отличие от Зафирлукаста не ингибирует микросомальные ферменты, поэтому не влияет на фармакокинетику других препаратов. Известно, что при блокаде CysLTR1 Монтелукастом значительно снижается эозинофильное воспаление, что сопровождается количественным уменьшением медиаторов: нейрокинина А и вещества Р в лаважной, назальной жидкости пациентов с полиппозом носа и астмой, с непереносимостью НПВС или без нее. [8]
Монтелукаст вводится внутрь, всасывается быстро. Его абсорбция от состава пищи не зависит. Метаболиты выделяются в основном кишечником. t
2,7-5,5 ч. Область применения такая же, как и у Зафирлукаста, но препарат рекомендован для применения взрослым и детям старше 6 месяцев. [3]
Зафирлукаст и Монтелукаст, в настоящее время, активно не используются в связи с низкой эффективностью и высокой стоимостью. Однако они имеют и свои преимущества: простой режим лечения, 1-2-кратный прием и появление эффекта в течение 24 часов после приема препарата. Также на фоне приема антилейкотриенов возможно развитие синдрома Черджа-Стросса, однако этот факт требует дальнейшего изучения. И в современной медицинской практике антагонисты лейкотриенов не применяются для куппирования приступов бронхиальной астмы. [8]
Антилейкотриены могут служить альтернативой монотерапии ингаляционными кортикостероидами при лечении легкой персистирующей астмы у взрослых и детей. Но из-за плохого контроля над астмой и, как следствие, возникновения приступов, и последующего назначения кортикостероидов использование лейкотриенов для монотерапии бронхиальной астмы пока остается под вопросом. Однако применение ингибиторов синтеза лейкотриенов может снизить необходимость экстренного применения ингаляционных стероидов или системного лечения стероидами. [6]
Изучение Конкрейновской базы данных показало, что использование антилейкотриенов при астме менее эффективно, чем использование ингаляционных кортикостероидов (ИГКС). Была проведена оценка 14 эксперементов, 12 из которых были проведены у взрослых, одно у взрослых и подростков (≥ 12лет), одно у детей (
10 лет). Продолжительность вмещательства варьировала от 4 до 37 недель. Из антилейкотриеновых препаратов использовали монтелукаст, пранлукаст и зафирлукаст. У пациентов, получавших антилейкотриены больше, чем кортикостероиды, наблюдалось увеличение обострений бронхиальной астмы. Из этого следует вывод, что применение кортикостероидов более эффективно. [7]
В нашей стране антилейкотриены обозначаются как дополнительная терапия в совокупности с ингаляционными кортикостероидами и являются альтернативой длительно действующим β2-агонистам при персистирующей бронхиальной астме. Но по сравнению с β2-агонистами монтелукаст менее эффективен и к тому же более дорогой.
Современная терапия бронхиальной астмы должна отвечать поставленным целям:
1. Достижение и поддержание контроля симптомов БА в течение длительного времени;
2. Минимизация рисков будущих обострений БА.
Именно поэтому был разработан специальный ступенчатый подход к ее лечению. Каждая ступень соответствует определенной выраженности клинических проявлений БА и представляет собой варианты ее терапии. По данной схеме антилейкотриены могут применять на 2, 3 и 4 ступенях.
На 2 ступени антилейкотриены рекомендуются для терапии пациентам с БА в сочетании с аллергическим ринитом, пациетам с вирусиндуцированной БА, с астмой физического усилия. На 3 ступени – у детей младше 5 лет в качестве дополнения к терапии ИГКС; у детей старше 5 лет лечения БА в качестве дополнения к базисной терапии низкими/средними дозами ИГКС. На 4 ступени детям 5-12 лет с неконтролируемым течением БА на фоне терапии 400 мкг беклометазона дипропионата или его эквивалнента в день в комбинации с длительно действующими бэта-агонистами (ДДБА) рекомендуется увеличение дозы ИГКС до максимальной в сочетании с ДДБА или добавление антилейкотриенов. (рис. 2) [1]
Таким образом, несмотря на большое количество исследований в данной области, эффективность применения антилейкотриеновых препаратов до сих пор остается под вопросом. При их назначении необходимо учитывать соотношение польза/вред, стадию течения бронхиальной астмы, индивидуальные реакции организма на препарат. Но одно можно сказать точно, антилейкотриеновые препараты – это достаточно перспективное направление в области лечения бронхиальной астмы, которое при дальнейшем развитии может привести к разработке новых препаратов и снижении побочных эффектов уже существующих.
Рисунок 2. Ступенчатая терапия бронхиальной астмы.
Роль и место антилейкотриеновых препаратов в лечении аллергических заболеваний
Рассмотрено лечение аллергического воспаления у больных бронхиальной астмой. Приведены показания к назначению антагонистов лейкотриеновых рецепторов, показана эффективность применения антилейкотриеновых препаратов при бронхиальной астме, в том числе у дет
Сегодня аллергические болезни входят в число самых распространенных хронических заболеваний. По данным Всемирной организации здравоохранения (ВОЗ) в мире насчитывается около 1 млрд людей, страдающих хроническими неинфекционными заболеваниями органов дыхания, из которых 300 млн больных бронхиальной астмой (БА), 400 млн больных аллергическим ринитом. В 2008 г. под эгидой ВОЗ Глобальный альянс по борьбе с хроническими респираторными заболеваниями (Global Alliance Against Chronic Respiratory Diseases, GARD) определил приоритетные направления, включающие сердечно-сосудистые заболевания, хронические респираторные заболевания, онкологию и сахарный диабет. Были сформулированы 6 задач, одной из которых является повышение значения и создание интегрированной профилактики и контроля заболеваний. Отдельно было подчеркнуто, что аллергия — один из известных факторов риска формирования хронических респираторных заболеваний [1].
«…Астма является хроническим воспалительным заболеванием, связанным с приходящей и изменяющейся по своей выраженности обструкцией дыхательных путей и гиперреактивностью бронхов, проявляющимся повторяющимися эпизодами хрипов, кашля, одышки и чувством стеснения в груди…» [2].
Создание и широкое использование в первую очередь ингаляционных глюкокортикостероидов (ИГКС) существенно повлияло на возможности достижения контроля течения заболевания. ИГКС, обладая мощным противовоспалительным действием, воздействуют на основные механизмы формирования БА.
В связи с высокой эффективностью ИГКС вполне правомочен вопрос, нужны ли другие препараты, способные подавить хроническое аллергическое воспаление у больных БА?
Несмотря на широкое использование ИГКС, у части больных не удается достигнуть контроля течения заболевания. В большинстве стран Европы больше половины пациентов с БА имеют неконтролируемое течение заболевания (рис. 1).
Причинами неконтролируемого течения БА являются отсутствие приверженности пациентов к проводимой базисной терапии, нежелание выполнить все предписания врача, отсутствие элиминации из окружения больного всех причинных аллергенов, поздняя диагностика и неадекватная терапия на ранних этапах заболевания, наличие различных фенотипов и эндотипов астмы, избирательная чувствительность к различным средствам базисной терапии астмы.
Согласно основным международным документам, регламентирующим тактику лечения детей с БА, к средствам базисной терапии, влияющим на хроническое воспаление дыхательных путей, относятся: глюкокортикостероиды, антагонисты лейкотриеновых рецепторов, пролонгированные ß2-агонисты в комбинации с ингаляционными глюкокортикостероидами, кромоны (кромоглициевая кислота, недокромил натрия), пролонгированные теофиллины и антитела к IgE. Пролонгированные ß2-агонисты могут лишь усиливать противовоспалительный эффект ИГКС и никогда не используются в качестве монотерапии астмы, кромоны по данным ряда исследований оказывают эффект, близкий к плацебо, а пролонгированные теофиллины редко используются у детей в связи с выраженными побочными действиями (Международный консенсус по астме у детей (ICON, International Consensus on Pediatric Asthma), 2012).
В области лечения БА в последнем десятилетии успешно прошли испытания две группы препаратов: это антилейкотриеновые препараты (АЛТП) и анти-IgE-препараты.
1) ингибиторы 5-липооксигеназы (5-LO, биосинтез лейкотриенов): зилейтон (Зифло)*, используется главным образом в США;
2) цистеиниловые лейкотриеновые (CysLT1) антагонисты: монтелукаст (Сингуляр), зафирлукаст (Аколат) и пранлукаст (Онон)**.
Проводятся клинические исследования (еще нет в клинической практике) так называемых ингибиторов FLAP, которые препятствуют 5-LO-активации белков.
АЛТП классифицируются как препараты, контролирующие течение БА, и характеризуются высокой эффективностью контроля течения БА у детей [1, 36].
Показания к назначению антагонистов лейкотриеновых рецепторов:
Согласно международным согласительным документам антагонисты лейкотриеновых рецепторов используются начиная с 1-й ступени терапии в качестве монотерапии или со 2-й ступени терапии в комбинации с ИГКС (рис. 2).
Лейкотриены являются одними из основных медиаторов формирования хронического воспаления дыхательных путей у больных БА. Бронхоспазм, который вызывают лейкотриены, в 1000 раз более мощный, чем гистамин. Лейкотриены вызывают повышение проницаемости сосудов, увеличение продукции и секреции слизистыми железами дыхательных путей, увеличение клеточной инфильтрации слизистой оболочки дыхательных путей, ремоделирование бронхов. Ремоделирование бронхов характеризуется массовой гибелью эпителиальных клеток, большим количеством слизистых пробок в бронхах, утолщением базальной мембраны, гипертрофией и гиперплазией бокаловидных клеток и серозных желез, гипертрофией гладких мышц стенки бронхов (более чем на 200%), активным ангионеогенезом [4, 5].
Лейкотриены образуются при взаимодействии фермента 5-липоксигеназы (5-ЛО) и 5-липоксигеназа-активирующего белка (ПЛАБ) (рис. 3). В результате этого взаимодействия арахидоновая кислота (высвобождающаяся в ответ на различные стимулы) превращается в 5-гидропероксиэйкозатетраеновую кислоту (5-ГПЭТЕ), затем в лейкотриен A4 (LTA4), отличающийся крайней нестабильностью. В дальнейшем под действием LTA4 гидролазы нейтрофилов, моноцитов периферической крови и альвеолярных макрофагов он превращается в лейкотриен B4 (LTB4) или происходит его конъюгация с образованием лейкотриена C4 (LTC4). Дальнейшее превращение LTC4 в лейкотриен D4 (LTD4), а затем LTD4 в лейкотриен E4 (LTE4) катализируется широко распространенными в тканях и циркулирующими в крови ферментами — соответственно гамма-глутамилтранспептидазой и дипептидазой. LTC4, LTD4 и LTE4 называют цистеиниловыми лейкотриенами (старое название этой группы лейкотриенов — медленно реагирующая субстанция анафилаксии), так как в их состав входит цистеин. Цистеиниловые лейкотриены, являясь ключевыми медиаторами в патогенезе БА, повышают продукцию слизи, вызывают развитие отека, эозинофилию и бронхоспазм. LTB4 играет менее важную роль в патогенезе БА. К основным биологическим эффектам LTB4 относятся влияние на хемотаксис и иммуномодуляция. Лейкотриены синтезируются в активированных эозинофилах, нейтрофилах, тучных клетках, моноцитах и макрофагах. В активированных эозинофилах и тучных клетках преимущественно образуется LTC4, в то время как моноциты и макрофаги синтезируют как LTB4, так и LTC4. Цистеиниловые лейкотриены LTC4, LTD4 и LTE4 вырабатываются у чувствительных лиц в ответ на различные стимулы, в том числе аллергены, физическую нагрузку и Аспирин. LTA4 образуется и высвобождается многими клетками, и в дальнейшем он превращается при участии других клеток в LTB4 и/или цистеиниловые лейкотриены. Как для ранней, так и для поздней фазы аллергического ответа характерно индуцированное аллергеном высвобождение цистеиниловых лейкотриенов из клеток воспаления, в том числе тучных клеток, эозинофилов, базофилов, макрофагов и моноцитов [6].
Цистеиниловые лейкотриены (LTC4, LTD4, LTE4) участвуют в развитии бронхиальной обструкции, гиперреактивности и образовании воспалительного экссудата в дыхательных путях при БА благодаря четырем основным механизмам:
Эффекты цистеиниловых лейкотриенов опосредуются рецепторами. У человека найдены, по меньшей мере, два вида таких рецепторов (подтипы 1 и 2). Рецептор к цистеиниловым лейкотриенам 1-го подтипа (CysLT1) — это основной рецептор, опосредующий эффекты цистеиниловых лейкотриенов при БА. Рецепторы CysLT1 были обнаружены в перибронхиальных гладкомышечных клетках и ключевых клетках воспаления: эозинофилах, моноцитах и макрофагах, B-клетках, а также клетках-предшественниках CD34 + (плюрипотентные гемопоэтические стволовые клетки).
У пациентов с атопической БА обнаружены повышенные уровни CD34 + клеток в слизистой бронхов. Экспрессия на этих клетках рецептора CysLT1 позволяет предположить, что при определенных условиях лейкотриены могут воздействовать на пути дифференцировки CD34+ клеток в различные виды клеток воспаления. Цистеиниловые лейкотриены могут подготавливать клетки-предшественники CD34 + к созреванию с образованием эозинофилов, моноцитов, макрофагов и определенных лимфоцитарных клеток периферической крови. При обострении БА лейкотриены, образованные в легких при участии эозинофилов и макрофагов, могут активировать рецепторы CysLT1 гладкой мускулатуры бронхов, вызывая бронхоспазм. Кроме того, цистеиниловые лейкотриены могут усиливать непосредственное повреждение легочной ткани и расширять популяции клеток воспаления в легких вследствие аутокринного и паракринного воздействия на рецепторы CysLT1, расположенные на интерстициальных предшественниках гранулоцитов, эозинофилов и/или макрофагов. Такой механизм положительной обратной связи может объяснять наблюдаемые в клинических условиях прогрессирующие бронхоспазм и воспаление, характерные для БА [7, 14].
Согласно современным представлениям БА рассматривают как гетерогенное заболевание, имеющее множество фенотипов. Выделяют эозинофильный, нейтрофильный и пауцигранулоцитарный (обедненный по клеточным элементам) фенотипы.
При эозинофильном фенотипе БА ключевой клеткой воспаления является эозинофил, активация которой происходит под влиянием интерлейкина 5 (ИЛ-5), образующегося после взаимодействия аллергена и Т-хелперов 2 (Th2) клеток. Активированный эозинофил высвобождает эозинофильный катионный белок (ECP), основной белок эозинофилов (MBP) и матриксную металлопротеиназу-9 (MMP9) с формированием аллергического воспаления дыхательных путей у больных БА. При нейтрофильном воспалении ключевыми клетками являются макрофаги и эпителиальные клетки. Высвобождающийся из этих клеток интерлейкин 8 (ИЛ-8) приводит к привлечению к месту воспаления нейтрофилов с высвобождением нейтрофильных факторов, приводящих и поддерживающих воспаление бронхов у больных БА. Использование ИГКС приводит у больных БА к подавлению в первую очередь эозинофильного воспаления. Нейтрофильное воспаление у больных БА значительно хуже реагирует на использование данной группы базисных препаратов. В ряде исследований было показано, что монтелукаст в терапевтической дозе подавляет воспаление в дыхательных путях у больных БА, вызванное не только эозинофилами и моноцитами, но и кортикостероид-нечувствительными нейтрофилами [8].
Для воздействия на разные звенья каскада арахидоновой кислоты были разработаны различные классы лекарственных препаратов. К ингибиторам синтеза лейкотриенов относятся ингибиторы 5-ЛО, которые напрямую блокируют каталитическую активность 5-ЛО, а также ингибиторы ПЛАБ, которые вытесняют арахидонат из места связывания с молекулой ПЛАБ и препятствуют поступлению арахидоната — субстрата для синтеза лейкотриенов — к 5-ЛО. Антагонисты рецепторов цистеиниловых лейкотриенов селективно угнетают активность цистеиниловых лейкотриенов на рецепторе LTD4 [9–11]. К этому классу относятся монтелукаст, пранлукаст и зафирлукаст [12].
Хотя считается, что кортикостероиды угнетают образование фосфолипазы A2, тем самым предотвращая формирование всех продуктов арахидонового каскада, исследования показали, что они не оказывают влияния на стимулированное аллергеном высвобождение цистеиниловых лейкотриенов в жидкость бронхоальвеолярного лаважа у пациентов с БА [14].
Z. Csoma с соавт. (2002) исследовали воспаление в дыхательных путях у детей с БА с помощью измерения уровней цистеиниловых лейкотриенов в конденсате выдыхаемого воздуха. В исследование включали детей в возрасте 7–14 лет, в том числе детей без БА и атопии (контрольная группа), детей с легкой интермиттирующей БА, детей с легкой, среднетяжелой и тяжелой персистирующей БА, получавших ИГКС. Исследование конденсата выдыхаемого воздуха показало, что у детей с персистирующей БА уровни цистеиниловых лейкотриенов были статистически значимо выше, чем у здоровых детей. У детей с легкой интермиттирующей БА уровни цистеиниловых лейкотриенов статистически значимо не отличались от уровней у здоровых детей. На фоне терапии ИГКС уровни цистеиниловых лейкотриенов в конденсате выдыхаемого воздуха были повышены у детей с легкой, среднетяжелой и тяжелой БА. Таким образом, дозы ИГКС, обеспечивающие контроль клинических проявлений БА у детей, могут не полностью угнетать воспалительный процесс. Длительное лечение астмы ИГКС, не обеспечивая явного угнетения синтеза лейкотриенов, может приводить к дальнейшему высвобождению медиаторов воспаления, участвующих в привлечении клеток воспаления и, тем самым, поддержании хронического воспаления в дыхательных путях [16].
В другом открытом перекрестном исследовании с двумя периодами участвовали 23 ребенка в возрасте 6–11 лет, страдавших среднетяжелой БА, имевших значение объема форсированного выдоха за первую секунду (ОФВ1) 60–85% от должного. При этом прирост ОФВ1 после ингаляции ß-агониста у включенных в это исследование больных составил ≥ 12%. После двухнедельного вводного периода детям назначали терапию монтелукастом (таблетка 5 мг один раз в сутки) или кромолином (2 ингаляции по 1 мг 4 раза в сутки) в течение 4 недель с последующим периодом «отмывки» между разными видами терапии продолжительностью 2 недели. По потребности применялись ß2-агонисты. До и после лечения каждого вида измеряли концентрации LTC4 в смывах со слизистой полости носа. Терапия монтелукастом в течение 4 недель приводила к статистически значимому снижению концентраций LTC4 (p 400 мкг. Часть детей получала дополнительную терапию системными кортикостероидами перед бронхоскопией. Монтелукаст получали 10 из 24 больных, включенных в данное исследование. Результаты исследования конденсата выдыхаемого воздуха показали, что концентрации цистеиниловых лейкотриенов у детей, получавших монтелукаст, были значительно ниже, чем у тех детей, которые получали только ИГКС (p = 0,004). Кроме того, в группе терапии ИГКС отмечена статистически значимая корреляция концентраций цистеиниловых лейкотриенов со степенью утолщения ретикулярной базальной мембраны, отражающая степень ремоделирования бронхов (p = 0,003) [18].
Хорошо известен факт нарастания частоты обращений для оказания экстренной помощи детей с БА в осенне-зимний период в связи с увеличением частоты острых респираторных инфекций в этот сезон. Изучение эффективности монтелукаста для профилактики обострений БА, индуцированной вирусной инфекцией (исследование PREVIA), было проведено, чтобы оценить влияние терапии монтелукастом в течение 12 месяцев по сравнению с плацебо на симптомы БА, связанные с простудными заболеваниями, у детей в возрасте 2–5 лет, страдающих БА.
PREVIA — это многоцентровое рандомизированное двойное слепое плацебо-контролированное исследование в параллельных группах продолжительностью 12 месяцев. После двухнедельного вводного периода (пациенты принимали плацебо, не зная, какой препарат принимают) соответствующие критериям включения пациенты были рандомизированы двойным слепым методом в группы терапии монтелукастом или плацебо на протяжении 12 месяцев. Монтелукаст назначали в виде жевательной таблетки 4 мг один раз в сутки перед сном. Критерием включения в исследование был возраст (от 2 до 5 лет), в анамнезе наличие не менее трех обструкций на фоне ОРИ, требовавших применения ß-агониста, длительностью ≥ 3 дней, развившихся за последние 12 месяцев, и если хотя бы один из этих эпизодов развился в течение 6 месяцев перед включением. Кроме того, пациенты должны были страдать легкой БА. По сравнению с плацебо монтелукаст статистически значимо снижал частоту обострений (32%, p ≤ 0,001). Рассчитанная частота обострений составила 1,60 эпизода в год в группе монтелукаста по сравнению с 2,34 эпизода в год в группе плацебо. В результате исследования был сделан вывод, что у детей с БА в возрасте 2–5 лет монтелукаст в дозе 4 мг является эффективным, удобным и хорошо переносимым средством достижения контроля над БА, обеспечивая уменьшение выраженности дневных и ночных симптомов БА и уменьшение частоты обострений [19].
Продукты метаболизма арахидоновой кислоты имеют существенное значение в развитии астмы, индуцированной физической нагрузкой. Использование антилейкотриеновых препаратов предупреждает развитие бронхоспазма, вызванного физической нагрузкой [20]. В исследовании, проведенном J. P. Kemp и соавт. (1998), монтелукаст предупреждал бронхоконстрикцию, вызванную физической нагрузкой, у детей 6–14 лет. Целью этого двойного слепого рандомизированного плацебо-контролируемого перекрестного исследования с двумя периодами, включавшего 27 детей с астмой 6–14 лет, являлась оценка влияния монтелукаста по сравнению с плацебо на бронхоконстрикцию, обусловленную физической нагрузкой. Дети, включенные в исследование, имели снижение ОФВ1 ≥ 20% после стандартизованной нагрузки на тредмиле до начала терапии. Во время каждого периода исследования дети получали монтелукаст 5 мг или плацебо 1 раз в сутки вечером в течение 2 дней. Провокационный тест со стандартизованной нагрузкой проводили вечером примерно через 20–24 ч после приема второй дозы исследуемого препарата. Длительность периода вымывания между периодами исследования составляла ≤ 4 дней. По сравнению с плацебо монтелукаст обусловливал статистически значимое уменьшение выраженности падения ОФВ1 (–18%) по сравнению с –26% (p = 0,009). Кроме того, время восстановления ОФВ1 к значению до нагрузки на фоне терапии монтелукастом было меньше, чем на фоне плацебо (соответственно 18 минут и 28 минут) [21].
Аллергический ринит — частое сопутствующее заболевание у больных БА. Изолированный аллергический ринит увеличивает риск развития астмы. Клинические исследования монтелукаста показали его эффективность при монотерапии сезонного аллергического ринита, сопоставимую с эффективностью антигистаминных препаратов нового поколения. В случае комбинации препаратов этих групп эффективность терапии сопоставима с эффективностью лечения интраназальными стероидами. В случае легкого течения аллергического ринита монтелукаст может быть препаратом выбора. Отмечается улучшение качества жизни и у больных с симптомами риноконъюнктивита [31, 32]. Также обосновано применение данной группы препаратов при бронхиальной астме, сопровождающейся аллергическим ринитом.
Аспириновая астма диагностируется у детей очень редко. Это связано с тем, что классическая триада симптомов (астма, полипозные образования в придаточных пазухах носа и непереносимость нестероидных противовоспалительных препаратов) появляется в более старшем возрасте и редко симптомы появляются одновременно. Однако у детей с неатопической астмой следует всегда исключать аспириновую астму, даже если нет всей классической симптоматики, характеризующей данную форму у взрослых. Кроме того, не следует забывать, что возможно сочетание как аллергической, так и аспириновой астмы у одного больного. У больных с аспириновой астмой отмечается повышенный синтез цистеиниловых лейкотриенов. В качестве базисной терапии следует использовать ИГКС в сочетании с АЛТП. Назначение АЛТП уменьшает рост назальных полипов. К лучшему ответу на АЛТП предрасположены больные с БА, имеющие «мутации» в промоторной зоне гена, кодирующего LTC4 синтазу [22].
Другой редко диагностируемой формой астмы является «кашлевая» астма (CVA). Длительно кашляющие дети представляют собой достаточно большую группу больных, имеющих различные заболевания. Диагностировать данную форму астмы следует согласно имеющимся критериям, опубликованным в международных согласительных документах Всемирной инициативы по борьбе с бронхиальной астмой (Global Initiative for Asthma, GINA). Подбор терапии таким детям не всегда прост, и к диагнозу аллергического поражения бронхов врач подходит, как правило, исключив другие заболевания.
По данным Т. Kita с соавт. (2010), обследовавшего 75 больных с «кашлевым» вариантом астмы, монтелукаст может эффективно использоваться для лечения в качестве монотерапии [23]. У больных CVA 2-недельное лечение монтелукастом, кленбутеролом и монтелукастом плюс кленбутерол оказалось эффективным. В группе больных, получающих монтелукаст в комбинации с кленбутеролом, значение пиковой скорости выдоха (ПСВ) в утренние и в вечерние часы значительно увеличились после 2 недель лечения по сравнению со значениями ПСВ до лечения. У пациентов с аллергическим трахеобронхитом 2-недельное лечение монтелукастом, кленбутеролом и комбинацией «монтелукаст плюс кленбутерол» оказалось неэффективным и достоверных различий получено не было.
У больных с легкой персистирующей астмой или на 1-й ступени в качестве базисного препарата можно использовать либо низкие дозы ИГКС, либо АЛТП [2]. Исследование MOSAIC ставило перед собой цель сравнить уровень контроля астмы, достигнутый на фоне терапии пероральным монтелукастом и низкими дозами ингаляционного флутиказона по проценту дней без применения препаратов по экстренным показаниям через 1 год лечения у детей в возрасте 6–14 лет при легкой персистирующей БА. Исследование MOSAIC являлось рандомизированным одногодичным двойным слепым исследованием в двух параллельных группах. После 4 недель простого слепого вводного периода, в течение которого пациенты получали плацебо, пациентов рандомизировали в соотношении 1:1 в группы терапии: либо монтелукаст 5 мг в виде жевательной таблетки один раз в сутки перед сном или флутиказон 2 ингаляции 50 мкг 2 раза в сутки. Длительность лечения составляла 1 год. Все пациенты могли использовать ß2-агонисты короткого действия по требованию или пероральные стероиды. Интервалы между визитами в клинику составляли 4 месяца. Оценка контроля астмы проводилась с помощью раздела «контроль» Педиатрического опросника для оценки терапии астмы — PATAQ (Control domain of the Paediatric Asthma Therapy Assessment Questionnaire). Доля пациентов без приступов астмы составила 67,8% в группе монтелукаста и 74,4% в группе флутиказона. Отношение рисков составило 1,38 в пользу флутиказона (95% ДИ: 1,04, 1,84). В двух группах отмечены сходные изменения ОФВ1 по сравнению с исходным уровнем: ОФВ1 увеличился после лечения как в группе монтелукаста, так и в группе флутиказона. В среднем использование ß2-агониста снизилось с 7,0 (исходно) до 2,6 ингаляции в неделю после терапии монтелукастом и с 7,2 до 2,3 ингаляции в группе флутиказона (статистически достоверной разницы нет). Средняя доля дней использования ß2-агониста уменьшилась с 38,0% (исходно) до 15,4% (после лечения) в группе монтелукаста и с 38,5% до 12,8% в группе флутиказона. После терапии монтелукастом количество эозинофилов периферической крови снизилось как в группе монтелукаста, так и в группе флутиказона (без статистически достоверной разницы).
Результаты исследования MOSAIC показали, что у детей в возрасте 6–14 лет с легкой персистирующей астмой монтелукаст был сопоставим с флутиказоном по увеличению доли дней без терапии астмы по экстренным показаниям. Оба препарата в целом хорошо переносились [24].
Для оценки приверженности к терапии в современной медицинской литературе используются ряд терминов: «сompliance», «adherence», «concordance».
Достаточно интересные результаты были получены при сравнении использования таблетированного препарата (монтелукаст) и ИГКС (беклометазон) в виде дозированного ингалятора. Цель исследования была оценить предпочтения/приверженность терапии при сравнении монтелукаста и ИГКС. Было обследовано 124 ребенка с астмой в возрасте 6–14 лет. Фаза наблюдения составила 6 месяцев [30]. Дети, участвовавшие в исследовании, чаще выполняли назначения по применению монтелукаста, чем беклометазона. Средняя доля дней, в течение которых пациенты полностью выполняли назначения, составила 98% в группе монтелукаста и 83% в группе беклометазона. Различия между группами достигали 15% и были статистически значимыми (p
* Зилейтон в РФ не зарегистрирован.
** Пранлукаст в РФ не зарегистрирован.
Г. А. Новик, доктор медицинских наук, профессор
ГБОУ ВПО СПбГПМУ МЗ РФ, Санкт-Петербург
Abstract. Treatment of allergic inflammation with bronchial asthma patients has been analyzed. Indications to prescription of leukotriene receptor blocking agents are discussed, effectiveness of application of anti-leukotriene preparations with bronchial asthma including its application for children has been shown.




.gif)
.gif)
.gif)
.gif)