Ликворные пространства головного мозга расширены у взрослого что
Нарушения внутричерепного давления
Относительная замкнутость полости мозгового черепа ведет к тому, что уменьшение или увеличение объема его содержимого сопровождается соответственно внутричерепной гипотензией или гипертензией. При внутричерепной гипотензии давление ликвора ниже 100 мм водного столба, при гипертензии – выше 180–200 мм водного столба.
1) Внутричерепная гипотензия. Возникает по ряду причин. Основной является истечение ликвора, или ликворея (лат. liquor – жидкость; греч. rheo – теку), при переломах костей черепа.
Особенно часто ликворея возникает при переломах решетчатой кости и пирамиды височной кости, а также костей основания черепа, при этом разрываются оба листка твердой мозговой оболочки с последующим истечением ликвора через нос. При переломе решетчатой кости наблюдается ликворея из носа. При переломе пирамиды височной кости ликвор проникает в барабанную полость среднего уха. Если повреждена барабанная перепонка, то ликвор течет из уха. Если же она цела, ликвор попадает в евстахиеву (слуховую) трубу, соединяющую полость среднего уха с носоглоткой. Из слуховой трубы ликвор проникает в носоглотку, а затем выделяется через нос и частично проглатывается.
Другая причина ликвореи – медицинские манипуляции: изъятие значительного количества ликвора при пункции желудочков мозга или ликворных цистерн, а также техническая погрешность, то есть повреждение твердой мозговой оболочки слишком толстой иглой. Опасность ликвореи состоит в том, что значительно возрастает риск инфицирования мозга и его оболочек.
При внутричерепной гипотензии меняется состояние окружающего мозг субарахноидального пространства – ликворной «подушки». При этом происходит изменение натяжения сосудов и нервов, выполняющих функцию «якорных» образований, а также раздражение мозговых оболочек.
Клинические проявления ликворной гипотензии:
— возникает упорная диффузная головная боль, особенно интенсивная в области затылка («дренажная» или «пункционная» головная боль, если она связана с забором ликвора);
— головная боль усиливается при быстрых поворотах головы, ходьбе («каждый шаг отдает в голову»), переходе из горизонтального положения в вертикальное;
— головная боль часто сопровождается тошнотой, рвотой, несистемным головокружением (неуверенностью при стоянии, передвижении), ощущением «тумана» перед глазами. Если пациент некоторое время лежит в постели с приподнятым ножным концом, головная боль уменьшается;
— характерны также вялость, апатия, повышенная утомляемость, нарушение концентрации внимания, тенденция к учащению пульса (до 85–100 ударов в минуту);
— могут выявляться легкие признаки менингеального синдрома – «менингизм» (термин указывает на раздражение мозговых оболочек невоспалительной этиологии).
Лечение ликворной гипотензии: постельный режим, избегание физических нагрузок, обильное питье, устранение дефекта твердой мозговой оболочки.
2) Ликворная гипертензия. Возникает при увеличении суммарного объема расположенных в полости черепа тканей. Это происходит по разным причинам: отек мозга, венозный застой, гидроцефалия, объемные процессы (опухоль, абсцесс, паразитарная киста, инфекционная гранулема и др.), различные повреждения мозга и его оболочек (менингит, энцефалит, арахноидит, черепно-мозговая травма, эклампсия беременных, эпилептический статус), гипонатриемия с поступлением воды из крови в ткань мозга, гипоксия, интоксикация. При краниостенозе и вдавленном переломе костей свода черепа наблюдается уменьшение объема черепной коробки.
Различают две стадии развития или существования внутричерепной гипертензии.
1. Компенсированная стадия – это состояние, при котором увеличение суммарного объема внутричерепных тканей компенсируется уменьшением количества крови и ликвора. В этом случае кровь перемещается из сосудов полости черепа в резервные сосудистые пространства, а ликвор начинает усиленно всасываться и/или замедляется его секреция. Клинически эта стадия себя не проявляет.
2. При истощении резервных возможностей наступает 2-я стадия – декомпенсация внутричерепной гипертензии с характерной и нарастающей симптоматикой. Нарушается мозговое кровообращение, так как падает перфузионное давление в сосудах мозга (оно определяется как разница между средним артериальным давлением и внутричерепным давлением). Если перфузионное давление оказывается ниже 50 мм рт. ст., наступает стадия декомпенсации – артериальный кровоток становится недостаточным. Когда разница становится нулевой, он полностью прекращается.
Клиническая картина внутричерепной гипертензии (ВЧГ):
— в начале развития ВЧГ характеризуется преимущественно приступообразной головной болью, возникающей и наиболее интенсивной чаще по утрам;
— затем присоединяется нарастающая диффузная головная боль распирающего характера. Она усиливается при кашле, чихании, физическом напряжении, движении головой, сгибании и разгибании шеи, сдавлении вен на шее;
— наблюдается «мозговая», не связанная с приемом пищи рвота;
— появляется отек дисков зрительных нервов, чреватый вторичной атрофией зрительных нервов и потерей зрения;
— тяжелейшим осложнением внутричерепной гипертензии является смещение и вклинение мозговых структур в щели между листками твердой мозговой оболочки.
Количество расширенных пространств вирхова-робина связано с возрастом, артериальным давлением и мр-маркерами болезни мелких сосудов
Материалы и методы
Выборка исследования
Исследование Three-City (3С) является когортным исследованием, проведенным в трех городах Франции (Бордо, Дижон, Монпелье), целью которого была оценка риска развития деменции и когнитивных нарушений, связанных с сосудистыми факторами риска. В выборку исследования вошли лица в возрасте 65 лет и старше, не находящиеся на стационарном лечении, случайно выбранные из списков избирателей в каждом из трех городов. Среди 4931 человек, набранных в Дижоне, лицам моложе 80 лет и зачисленным в исследование в период с июня 1999 г. по сентябрь 2000 г. (n=2763) предложили пройти МРТ-исследование головного мозга. Подробное описание протокола исследования, одобренного Комитетом по этике Университетской клиники Кремлин-Бисетр, было изложено ранее [11]. Все участники исследования дали письменное информированное согласие.
Критериями исключения в отношении проведения МРТ-исследования были: наличие установленного кардиостимулятора, протеза клапанов сердца или любых других внутренних электрических или магнитных устройств; указание на наличие в анамнезе нейрохирургического вмешательства/аневризмы; клаустрофобия; наличие металлических фрагментов в организме (в глазах, головном или спинном мозге). В общей сложности согласие на проведение МРТ дали 2285 (83%) человек, но из-за финансовых ограничений фактически выполнили только 1924 процедуры МРТ головного мозга, из которых 48 были забракованы из-за наличия артефактов движения. В дальнейшем из исследования исключили лиц с деменцией, опухолями головного мозга или перенесенным инсультом (n=58). Таким образом окончательная выборка исследования включала 1818 человек.
МРТ головного мозга
МРТ-обследование проводили на томографе Magnetom с напряженностью магнитного поля 1,5 Тесла (Siemens, Эрланген, Германия). Получали Т1-взвешенные изображения головного мозга в последовательности инверсия-восстановление 3D fast spoiled-gradient echo – быстрое очищенное градиентное эхо (время повторения =97 мс; время задержки эхо-импульса =4 мс; время инверсионной задержки =600 мс; получали изображения во фронтальной плоскости). Размер аксиально переориентированной 3D матрицы составил 256×192×256 с размером воксела 1,0×0,98×0,98 мм3. Получали 124 среза, полностью охватывающие головной мозг. Т2-взвешенные и PD-взвешенные изображения головного мозга получали с использованием 2D двойной спин-эхо последовательности с двумя TE (время повторения =4400 мс; время задержки эхо-импульса 1=16 мс; время задержки эхо-импульса 2=98 мс). Полученные Т2-взвешенные и взвешенные по протонной плотности изображения состояли из 35 аксиальных срезов толщиной 3,5 мм (промежуток между срезами 0,5 мм) с размером матрицы 256×256 и 2D разрешением 0,98×0,98 мм2.
Кассификация РПВР
Для оценки выраженности рПВР использовали 3D МРТ высокого разрешения. В каждом случае анализ МР-изображений выполняли по Т1-взвешенным изображениям (Т1ВИ) при двукратном увеличении на мониторе с диагональю 27 дюймов. При помощи мультипланарного переформатирования все особенности повреждений просматривали одновременно в аксиальной, фронтальной и сагиттальной плоскостях. Анализировали Т2-взвешенные и взвешенные по протонной плотности изображения для подтверждения соответствия сигнала от зоны поражения сигналу от цереброспинальной жидкости (ЦСЖ).
Критериями наличия рПРВ считали обнаружение очагов с сигналом, сходным с сигналом от ЦСЖ (гипоинтенсивным на Т1ВИ и гиперинтенсивным на Т2ВИ) круглой, яйцевидной или линейной формы с максимальным диаметром менее 3 мм, гладкими четкими контурами и локализацией в зонах кровоснабжения перфорантных артерий. При наличии поражений, соответствующих всем вышеперечисленным критериям, но с диаметром, превышающим 3 мм, возникала необходимость дальнейшего их изучения с помощью мультипланарного переформатирования для дифференциации их от инфарктов. К рПВР отнесли только те поражения, которые имели типичную форму сосуда и повторяли ход перфорантной артерии (в т. ч. кистозные поражения по ходу сосуда).
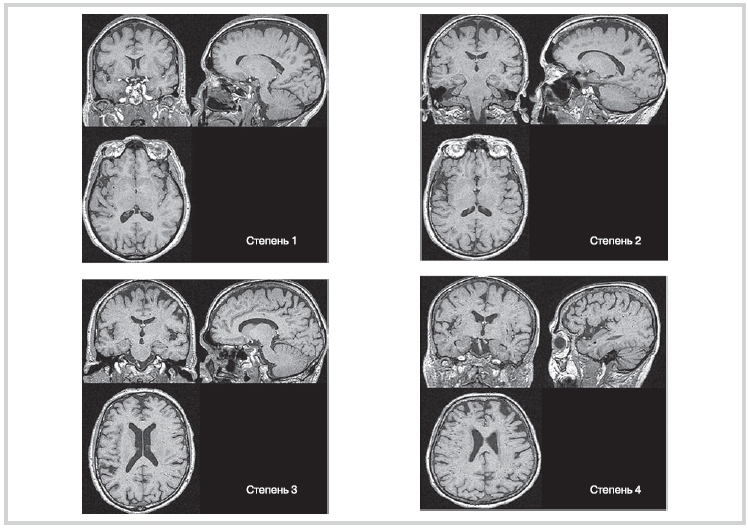
У каждого участника исследования изучали все 124 Т1ВИ в аксиальной плоскости с целью оценки глобального распределения рПВР и определения срезов, содержащих наибольшее количество рПВР в базальных ганглиях (БГ) и БВ. В случаях, когда возникали затруднения с категоризацией поражений, использовали одновременно полученные Т2-взвешенные и взвешенные по протонной плотности изображения для проверки идентичности сигнала сигналу от ЦСЖ. Затем по четырехуровневой шкале распространенности рПВР проводили ее оценку по срезам на уровне БГ, содержащих наибольшее количество рПВР. Степени рПВР определили следующим образом: 1 степень – наличие 5 рПВР; 2 степень – от 5 до 10 рПВР; 3 степень – более 10 рПВР с возможностью их количественной оценки, 4 степень – бесчисленное множество рПВР в результате криброзных изменений в БГ (рис. 1). В белом веществе головного мозга определили следующие 4 степени рПВР: 1 степень – более 10 рПВР во всем белом веществе, 2 степень – более 10 рПВР во всем белом веществе и менее 10 рПВР в срезе, содержащем наибольшее количество рПВР; 3 степень – от 10 до 20 рПВР в срезе, содержащем наибольшее количество рПВР, 4 степень – более 20 рПВР в срезе, содержащем наибольшее количество рПВР (рис. 2). Эту схему оценки утвердили после тестирования различных визуальных методов оценки, в т.ч. по данным, представленным в литературе, по совокупности данных МРТ первых 150 участников исследования и после поэтапного внесения поправок на множественные сравнения. Один опытный рецензент, ослепленный относительно клинических данных, проанализировал все изображения. Межэкспертное согласие в отношении оценки количества рПВР оценивали по случайной выборке из 100 человек с интервалом в 1 месяц между первым и вторым этапами анализа, проведенными этим рецензентом; κ-статистика для межэкспертного согласия составила 0,77 при оценке срезов на уровне БГ и 0,75 – в БВ, что свидетельствует о высокой достоверности.
Рисунок 1. Различные степени рПВР при оценке области базальных ядер
Рисунок 2. Различные степени рПВР при оценке белого вещества головного мозга
Другие параметры МРТ
Объем областей гиперинтенсивного белого вещества (ГБВ) измерили с помощью утвержденного метода автоматизированной проверки изображений и проанализировали в качестве непрерывной переменной. Морфологические параметры (координаты центра масс, Евклидово расстояние до желудочковой системы, размер главных осей) рассчитали для каждой области ГБВ. При расстоянии от желудочковой системы более 10 мм зону ГБВ считали перивентрикулярной, во всех других случаях – глубокой.
Объемы серого, белого вещества и ЦСЖ оценивали с помощью методов воксельной морфометрии, подробно описанных ранее. У каждого участника исследования эти объемы рассчитывали как интеграл интенсивности воксела в соответствующих модулированных изображениях. Общий внутричерепной объем рассчитывали как сумму объемов серого вещества, БВ и ЦСЖ, а фракцию мозгового вещества определили как соотношение объема ткани мозга к общему внутричерепному объему.
Наличие лакунарных инфарктов оценивал по Т1-, Т2- и PD-взвешенным изображениям один и тот же рецензент. Признаком наличия лакунарных инфарктов были очаговые поражения диаметром от 3 до 15 мм, имеющие такие же характеристики сигнала, как и ЦСЖ во всех последовательностях, расположенные в области БГ или БВ, их дифференцировали от расширенных пространств Вирхова-Робина на основании вышеупомянутых критериев.
Ооценка факторов риска
Социально-демографические и клинические данные собирали квалифицированные психологи во время личной беседы с каждым участником исследования по месту его проживания. Считали, что у пациента есть ишемическая болезнь сердца (ИБС), если он указывал на наличие в анамнезе перенесенного инфаркта миокарда, аортокоронарного шунтирования или коронарной ангиопластики. Критериями наличия сахарного диабета были указания на использование противодиабетических препаратов или содержание глюкозы в крови натощак ≥7 ммоль/л. Критериями наличия гиперхолестеринемии были содержание общего холестерина ≥6,2 ммоль/л или использование гиполипидемических препаратов. Систолическое и диастолическое артериальное давление измеряли дважды в положении сидя с интервалом, как минимум, 5 минут. Для анализа использовали среднее значение двух измерений. Критериями наличия артериальной гипертензии (АГ) были повышение артериального давления (систолическое ≥140 мм рт. ст. и диастолическое давление ≥90 мм рт. ст.) или использование гипотензивных препаратов. Выделяли следующие статусы пациентов по отношению к курению: никогда не курил, курение в прошлом и курение в настоящее время. Полиморфизм гена APOE оценивали с помощью процедуры, описанной ранее, и учитывали наличие 4 аллелей APOE. С рецептурных бланков переписывали лекарственные препараты, которые принимали участники в течение 1 месяца до проведения собеседования, и кодировали их, согласно французскому переводу Анатомической терапевтической и химической классификационной системы Всемирной организации здравоохранения (Anatomic Therapeutical Chemical Classification of the World Health Organization).
Статистический анализ
Представлена описательная статистика по исходным потенциальным факторам риска, а также их приблизительное распределение в соответствии с распространенностью рПВР. Для проведения многофакторных перекрестных анализов рассчитали мультиномиальные модели логистической регрессии с рПВР, классифицированными по 4-уровневой системе, в качестве зависимой переменной и рПВР 1 степени в качестве контрольной категории. Каждую последующую категорию (рПВР 2, 3 или 4 степени) сравнивали с контрольной. Отдельные анализы выполнили для моделирования распределения рПВР в области БГ и БВ с учетом возраста, пола и общего внутричерепного объема. Такой же подход использовали для изучения связи между количеством рПВР и другими МР-маркерами. В этом случае в многофакторную модель в качестве переменной также включили наличие АГ. Поскольку выявили только 24 пациента с рПВР 4 степени в области БГ, для оценки риска чрезмерно сильной подгонки также выполнили приблизительные анализы и сравнили с результатами многофакторного анализа. Поскольку получили сходные результаты (данные не приведены), представлены только многофакторные модели. Все значения вероятностей были двусторонне-ограниченными; результаты со значением р
РЕЗУЛЬТАТЫ
Средний возраст пациентов составил 72,5 года (стандартное отклонение [СО]=4,1), 706 (38,8%) участников были мужчинами. У 88% участников были обнаружены рПВР 1 или 2 степени на уровне БГ, у 24 (1,3%) пациентов в этой же области выявили наличие рПРВ 4 степени. В БВ у 77% лиц обнаружили рПВР 1 или 2 степени и у 94 лиц (5,2%) – 4 степени.
Факторы риска, ассоциированные с выраженностью рпвр
Приблизительное распределение потенциальных факторов риска в соответствии со степенью рПВР и их связь с количеством рПВР на уровне БГ и в БВ представлены в таблицах 2 и 3 соответственно. При увеличении среднего возраста возрастала распространенность рПВР в обеих исследуемых областях мозга; каждое увеличение возраста на 1 СО было ассоциировано с более высокой вероятностью обнаружения высокой степени рПВР, в частности, 4 степени (вероятность для рПВР 4 степени на уровне БГ: ОШ=2,1; 95% ДИ от 1,4 до 3,2; в БВ: ОШ=1,5; 95% ДИ от 1,2 до 1,9) по сравнению с 1 степенью. Гендерные различия не были связаны с количеством рПВР в БВ (р=0,53), но у мужчин была выше вероятность обнаружения бoльшего количества рПВР на уровне БГ, в частности, 4 степени (ОШ=6,0, 95% ДИ от 1,8 до 19,8).
Доля пациентов с АГ увеличивалась параллельно росту степени рПВР по сравнению с пациентами, имеющими нормальное артериальное давление, у лиц с АГ была выше вероятность обнаружения рПВР высокой степени, как на уровне БГ (р=0,02), так и в БВ (р=0,048). Также удалось выявить связь между использованием гипотензивных препаратов и количеством рПВР независимо от их локализации, хотя вероятность наличия рПВР 4 степени была в два раза выше на уровне БГ (ОШ=3,5, 95% ДИ от 1,4 до 8,7; таблица 3), чем в БВ (ОШ=1,7, 95% ДИ от 1,1 до 2,7). Когда наличие АГ и использование гипотензивных препаратов рассмотрели в качестве отдельных переменных и ввели в ту же регрессионную модель, то по результатам обнаружили, что только использование гипотензивных препаратов оказалось связано с количеством рПВР как на уровне БГ (р=0,0001), так и в БВ (р=0,03). Мы также отметили, что гиперхолестеринемия было обратно пропорционально связана со степенью рПВР в БВ (р=0,04), но не выявили значимой связи со степенью рПВР на уровне БГ (р=0,68). Наконец, между количеством рПВР и статусом курения, наличием сахарного диабета, ИБС в анамнезе, генотипом АРОЕ связи не обнаружили.
Взаимосвязь между количеством рпвр и другими мр-маркерами
Средний (СО) общий объем ГБВ составил 5,5 (5,0) см3, из которых 4,0 (4,2) см3 приходилось на перивентрикулярную область и 1,5 (1,3) см3 на глубокие отделы мозга. Средняя фракция вещества мозга (СО) составила 0,72 (0,03). Наличие лакунарных инфарктов обнаружили у 121 (6,8%) участника исследования. При повышении степени рПВР средний объем ГБВ значительно увеличивался. Каждое увеличение объема ГБВ на 1 СО сопровождалось 2–3-кратным повышением вероятности наличия рПВР 2, 3 или 4 степени (по сравнению с 1 степенью) на уровне БГ по сравнению с БВ (например, вероятность наличия рПВР 4 степени на уровне БГ: ОШ=3,2, 95% ДИ от 2,5 до 4,1; в БВ: ОШ=1,2; 95% ДИ от 1,0 до 1,4). По результатам анализа типов ГБВ мы обнаружили, что большой объем глубоко расположеных зон ГБВ был связан с более высокими степенями рПВР независимо от локализации, в то время как объем перивентрикулярно расположенных очагов ГБВ был связан только со степенью рПВР на уровне БГ (р
ОБСУЖДЕНИЕ
Результаты данного исследования, проведенного в большой выборке из общей популяции, состоящей из 1818 пожилых людей, продемонстрировали, что количество рПВР четко коррелирует с возрастом и наличием АГ. Связь с АГ оказалась достоверной для рПВР в БВ и в области БГ, хотя была сильнее для локализации на уровне БГ. Мы также обнаружили, что количество рПВР было связано с объемом ГБВ и наличием лакунарных инфарктов, главным образом развивающихся в результате структурных изменений мелких церебральных перфорирующих артерий. Однако не удалось обнаружить связи между количеством рПВР и атрофией мозга.
Связь между наличием АГ или применением гипотензивных препаратов и количеством рПВР соответствует данным патологоанатомических исследований и свидетельствует о высокой распространенности рПВР в головном мозге пациентов с АГ. Этот результат, однако, отличается от данных МРТ-исследования с участием 816 амбулаторных пациентов, согласно которым после внесения поправок на возраст, пол и наличие деменции не удалось обнаружить достоверной связи между наличием АГ и количеством рПВР. Это расхождение может быть связано с различием в методе оценки, использованном в настоящем исследовании, поскольку в окончательном анализе учитывали только рПВР диаметром более 2 мм. При таком выборе критериев глобальное бремя рПВР можно оценить неадекватно, поскольку диаметр большинства из них составляет менее 2 мм.
Поразительное различие обнаружили при анализе количества рПВР в области БГ: у мужчин риск обнаружения рПВР 4 степени был в 6 раз выше, чем у женщин. До настоящего времени не было данных о таком различии в зависимости от пола и его трудно объяснить. Выявили слабую, но достоверную обратную пропорциональную связь между гиперхолестеринемией и числом рПВР. Интересно, что удалось обнаружить защитный эффект гиперхолестеринемии в отношении частоты развития микрокровоизлияний – другого МР-маркера болезни мелких сосудов. Была выдвинута гипотеза, что холестерин может модулировать связанные с возрастом и наличием АГ ультраструктурные изменения в микроциркуляторном русле, но это предположение необходимо проверить.
Результаты ранее проведенных патологоанатомических исследований позволили предположить, что периваскулярные пространства расширяются параллельно с уменьшением объема головного мозга. Наши данные не подтверждают этой гипотезы, поскольку нам не удалось обнаружить связи между степенью рПВР и фракцией вещества мозга.
Связь между количеством рПВР, наличием лакунарных инфарктов и объемом ГБВ позволяет предположить, что появление рПВР может быть, по крайней мере, отчасти следствием поражения мелких сосудов. Эти данные согласуются с данными патологоанатомических исследований, а также с результатами МРТ-исследования пациентов с инсультом. Можно предположить, что ультраструктурные изменения, наблюдаемые в стенке перфорирующих артерий головного мозга, обусловливающие увеличение числа субкортикальных ишемических поражений, могут также способствовать расширению периваскулярных пространств. В этот процесс могут быть вовлечены различные механизмы. Повышенная проницаемость стенки мелких сосудов ассоциирована с изменениями эндотелиальных клеток микроциркуляторного русла и их плотных соединений. Кроме того, структурные изменения в стенках микрососудов могут также затруднять наружный дренаж интерстициальной жидкости вдоль базальных мембран, происходящий, по всей вероятности, благодаря пульсации артерий.
Влияние возраста и АГ на количество рПВР, по всей видимости, сильнее для локализации поражений в области БГ, чем в БВ. Аналогичным образом связь между количеством рПВР и объемом ГБВ или наличием лакунарных инфарктов также, по всей видимости, сильнее для локализации в области БГ, чем в БВ. Эти результаты соответствуют данным, полученным у пациентов с лакунарным инсультом. Такое различие не является неожиданностью, т. к. количество рПВР в обеих областях совершенно не сопоставимо. Действительно, хотя методы оценки несколько отличаются, только у 23% (22 из 94) лиц с рПВР 4 степени в БВ обнаружили рПВР 3 или 4 степени в области БГ и у 42% (10 из 24) лиц с рПВР 4 степени в области БГ также обнаружили рПВР 3 или 4 степени в БВ (данные не приведены). Эти данные позволяют предположить, что, несмотря на то что некоторые основные факторы риска являются общими, механизмы, лежащие в основе развития рПВР в различных областях мозга, могут отличаться. Аналогичные различия в локализации по степени тяжести уже были описаны при различных патологических процессах, таких как фиброгиалиноз, липогиалиноз или отложение амилоида в сосудах микроциркуляторного русла в процессе старения. Эти различные патологические процессы могут привести к существенным различиям в проницаемости сосудистой стенки, последующем расширении пространств Вирхова-Робина и, как следствие, поражению собственно вещества мозга. Тот факт, что количество рПВР в области БГ связано с объемами перивентрикулярных и глубинных зон ГБВ, а количество рПВР в БВ связано только с объемом глубинных зон ГБВ, может объяснить различия в локализации основных патологических процессов. Связь между распределением количества рПВР по локализации и основными патологическими изменениями в микроциркуляторном русле, очевидно, заслуживает большего внимания и проведения дальнейших исследований.
К сильным сторонам данного исследования относятся популяционный дизайн и большое число пожилых участников. Мы использовали МРТ с высоким разрешением, малый размер воксела и мультипланарное переформатирование для проведения достоверного анализа числа рПВР. К потенциальным ограничениям относятся возможная недооценка количества мелких ишемических поражений, не всегда образующих полости, и полуколичественный анализ рПВР. Для определения степени распространенности рПВР использовали практичный метод, основанный на изучении срезов, содержащих наибольшее количество рПВР. Решение о его применении приняли после того, как по результатам первоначальной оценки нескольких десятков изображений подтвердили, что визуальный подсчет каждого рПВР был невыполним. В настоящем исследовании каждый из 124 аксиальных срезов тщательно изучили перед подсчетом числа рПВР в срезах, содержащих наибольшее их количество, а у лиц с небольшим числом рПВР в БВ встречаемость рПВР оценили на всех срезах.
Поскольку в исследовании использовали МРТ с миллиметровым разрешением в 3D, необходимо проведение дальнейших исследований по сравнению эффективности 3D и 2D МРТ в отношении выявления и оценки числа рПВР, что необходимо для определения генерализуемости полученных результатов на анализ изображений, полученных с помощью обычной 2D МРТ. По нашему мнению, в связи с тем, что рПВР, как правило, имеют небольшие размеры и типичную форму, для обнаружения и дифференцирования рПВР от других повреждений, действительно, необходимо применение техники с высоким разрешением и использование мультипланарных (или 3D) реконструкций.
В заключение, результаты данного исследования четко указывают на то, что у пожилых людей степень рПВР увеличивается с возрастом, при наличии АГ и других МР-маркеров болезни мелких сосудов, таких как поражение БВ и наличие лакунарных инфарктов. Полученные данные свидетельствуют о том, что число рПВР само по себе нужно рассматривать в качестве МР-маркера болезни мелких сосудов головного мозга в пожилом возрасте, а прогностическое и клиническое значение рПВР заслуживает дальнейшего изучения.