Лимфоидные элементы что это
Лимфоидные элементы что это
В классификации Всемирной организации здравоохранения опухолей гемопоэтической и лимфоидной тканей 2001 г. в статье, посвященном лимфомам, использованы основные классификационные принципы и с небольшими изменениями рубрикация опухолей, принятые в Пересмотре Европейско-Американской классификации лимфоидных опухолей 1994 г..
При выделении вариантов (типов) лимфом были учтены не только их морфологические особенности, но и своеобразие клинических проявлений, иммунофенотип опухолевых клеток, генетические аномалии. Значимость каждого из этих критериев в каждой конкретной категории различна. «Удельный вес» морфологической составляющей в идентификации различных вариантов лимфом довольно высок.
Однако морфологическая линия лимфопоэза изобилует «белыми пятнами», и узнаваемыми являются лишь клетки отдельных этапов дифференцировки, в связи с чем построить классификационную схему лимфоидных новообразований, с учетом их принадлежности к Т- или В-клеточным линиями и уровня дифференцировки оказалось возможным лишь благодаря достаточно полному представлению об иммуногенезе, отражающему процесс перехода лимфоидных клеток от незрелого в иммунологически дифференцированное состояние.
Современные представления о лимфопоэзе: этапах дифференцировки клеток этой линии и неопухолевых аналогах ряда лимфоидных новообразований — нашли отражение в работах J. Ferry и N. Harris.
Без преувеличений можно утверждать, что краеугольным камнем современной классификации лимфом является принцип морфоиммунологических сопоставлений. Основываясь на этом принципе, все лимфомы делят на опухоли из клеток-предшественниц (сюда включены и опухоли из клеток тимуса — центрального органа иммунной системы для Т-лимфоцитов) и опухоли из клеток с фенотипом лимфоидных элементов периферических органов иммунной системы (зрелые).
Последние составляют подавляющее большинство всех лимфом. Каждый из разделов представлен двумя основными категориями: В- и Т-клеточными лимфомами.
На сайте представлена краткая морфологическая характеристика лимфоидных опухолей: неходжкинских лимфом (НХЛ) и лимфомы Ходжкина (ЛХ) с изложением основных маркерных цитологических особенностей клеточного состава и структуры опухолевой ткани. Материал изложен в соответствии с рубрикацией классификации ВОЗ, так как она наиболее полно отражает многообразие типов, форм, вариантов злокачественных лимфом. Исключены некоторые крайне редкие варианты лимфом и лейкемии. В тексте использована терминология классификации ВОЗ.
В тех случаях, когда выделяемый в классификации ВОЗ тип опухоли имеет аналог в классификациях KILL и Working Formulation (WF, 1982), термины-синонимы, используемые в этих классификациях, даны в скобках. В классификации KILL систематизированы не только В-, но и Т-клеточные лимфомы, а классификация WF является своего рода «эсперанто» для работающих с различными классификациями.
Морфологическая характеристика ряда лимфом включает в себя цитологический анализ опухолевых клеток на материале пунктатов лимфатических узлов и мазков-отпечатков. Это касается наиболее часто встречаемых вариантов лимфом, при которых цитологические признаки играют весомую роль, достаточно хорошо разработаны и могут применяться в повседневной практике. Кроме того, необходимо построение дифференциального ряда при цитологической диагностике лимфом. Метод цитологической диагностики вариантов лимфом имеет свои объективные ограничения и должен сочетаться с анализом гистологической картины и данными иммунофенотипирования опухоли.
Только при рецидивах заболевания или в случаях, если невозможно выполнить биопсию в связи с тяжестью состояния больного, цитологический метод морфологической диагностики может считаться достаточным для начала терапии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лимфоидные элементы что это
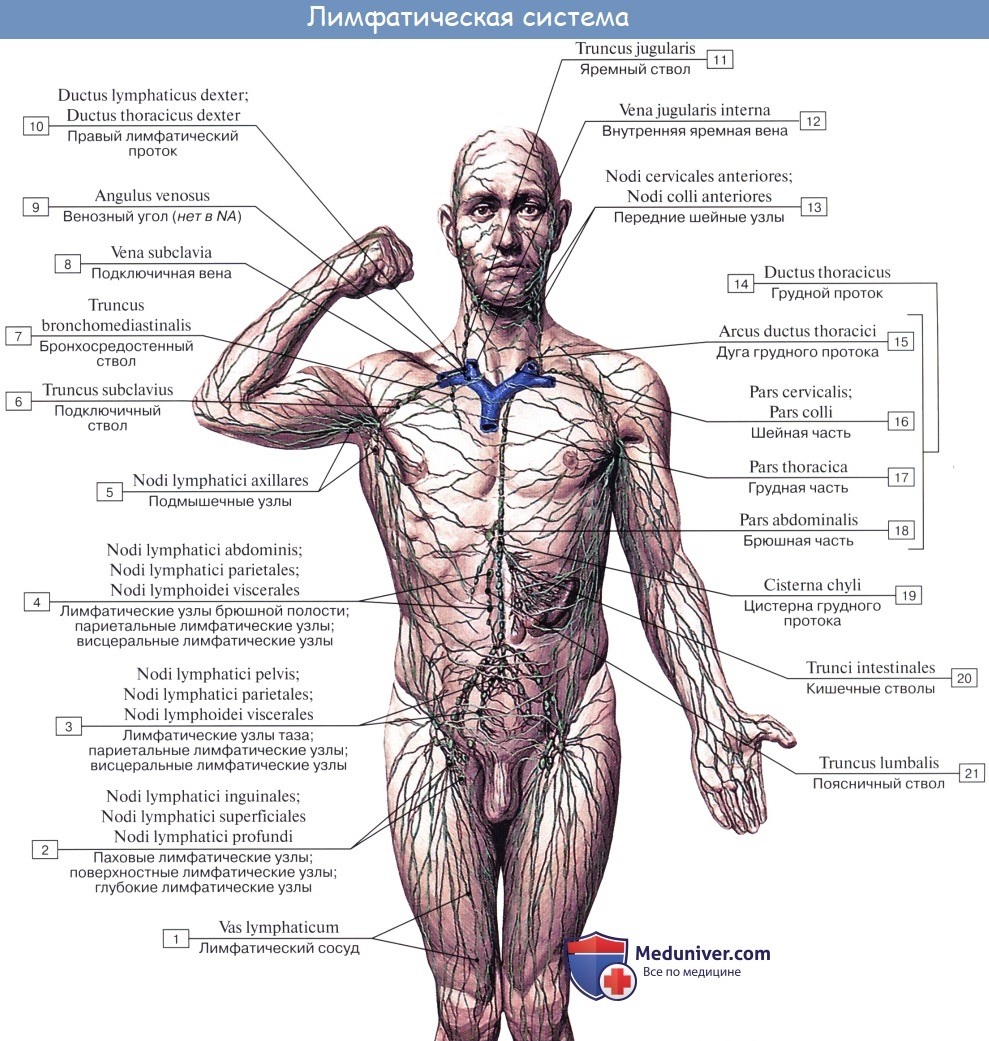
Лимфатическая система является составной частью сосудистой и представляет как бы добавочное русло венозной системы, в тесной связи с которой она развивается и с которой имеет сходные черты строения (наличие клапанов, направление тока лимфы от тканей к сердцу).
Ее основная функция — проведение лимфы от тканей в венозное русло (транспортная, резорбционная и дренажная функции), а также образование лимфоидных элементов (лимфопоэз), участвующих в иммунологических реакциях, и обезвреживание попадающих в организм инородных частиц, бактерий и т. п. (барьерная роль). По лимфатическим путям распространяются и клетки злокачественных опухолей (рак); для определения этих путей требуется глубокое знание анатомии лимфатической системы.
Соответственно отмеченным функциям лимфатическая система имеет в своем составе:
I. Пути, проводящие лимфу: лимфокапиллярные сосуды, лимфатические (лимфоносные, по В. В. Куприянову) сосуды, стволы и протоки.
II. Места развития лимфоцитов:
1) костный мозг и вилочковая железа;
2) лимфоидные образования в слизистых оболочках:
а) одиночные лимфатические узелки, folliculi lymphatici solitarii;
б) собранные в группы folliculi lymphatici aggregati;
в) образования лимфоидной ткани в форме миндалин, tonsillae;
3) скопления лимфоидной ткани в червеобразном отростке;
4) пульпа селезенки;
5) лимфатические узлы, nodi lymphatici.
Все эти образования одновременно выполняют и барьерную роль, Наличие лимфатических узлов отличает лимфатическую систему от венозной. Другим отличием от последней является то, что венозные капилляры сообщаются с артериальными, тогда как лимфатическая система представляет систему трубок, замкнутую на одном конце (периферическом) и открывающуюся другим концом (центральным) в венозное русло.
Лимфатическая система анатомически слагается из следующих частей:
1. Замкнутый конец лимфатического русла начинается сетью лимфокапиллярных сосудов, пронизывающих ткани органов в виде лимфокапиллярной сети.
2. Лимфокапиллярные сосуды переходят во внутриорганные сплетения мелких лимфатических сосудов.
3. Последние выходят из органов в виде более крупных отводящих лимфатических сосудов, прерывающихся на своем дальнейшем пути лимфатическими узлами.
4. Крупные лимфатические сосуды вливаются в лимфатические стволы и далее в главные лимфатические протоки тела — правый и грудной лимфатические протоки, которые впадают в крупные вены шеи.
Лимфокапиллярные сосуды осуществляют:
1) всасывание, резорбцию из тканей коллоидных растворов белковых веществ, не всасывающихся в кровеносные капилляры;
2) дополнительный к венам дренаж тканей, т. е. всасывание воды и растворенных в ней кристаллоидов;
3) удаление из тканей в патологических условиях инородных частиц и т. п.
Соответственно этому лимфокапиллярные сосуды представляют систему эндотелиальных трубок, пронизывающих почти все органы, кроме мозга, паренхимы селезенки, эпителиального покрова кожи, хрящей, роговицы, хрусталика глаза, плаценты и гипофиза.
Архитектура начальных лимфатических сетей различна. Направление петель последних соответствует направлению и положению пучков соединительной ткани, мышечных волокон, желез и других структурных элементов органа. Лимфокапиллярные сосуды составляют одно из звеньев микроцирку-ляторного русла. Лимфокапиллярный сосуд переходит в начальный, или собирающий, лимфатический сосуд (В. В. Куприянов), который затем переходит в отводящий лимфатический сосуд.
Лимфоидные элементы что это
1) функционально-генетическая классификация (пригодна для всех кроветворных органов):
— первичные или центральные (красный костный мозг; тимус);
— вторичные или периферические (селезенка; ЛУ, миндалины и др.);
2) морфо-функциональная классификация:
— экстралимфатические (тимус, миндалины, а также лимфоидные узелки и предузелки);
— лимфатические (ЛУ, а также лимфоидные бляшки и узелки).
Тимус занимает особое место в системе рециркуляции лимфоцитов (Хэм А., Кормак Д., 1983; Сапин М.Р., Этинген Л.Е., 1996). Наиболее простой вариант:
1) корковое вещество содержит кровеносные капилляры, которые заканчиваются в посткапиллярных венулах с высокими эндотелиоцитами мозгового вещества;
2) отток Т-лимфоцитов происходит из мозгового вещества тимуса через посткапиллярные венулы с высокими эндотелиоцитами.
Более сложный, дискуссионный вариант:
1) лимфоциты поступают в корковое вещество тимуса и уходят из него через капилляры;
2) мозговое вещество тимуса связано с паренхимой вторичных лимфоидных органов через посткапиллярные венулы с высокими эндотелиоцитами.
При этом также возможны варианты соотношения коркового и мозгового вещества тимуса:
1) они не взаимосвязаны (нет перехода лимфоцитов между ними);
2) взаимосвязаны (часть лимфоцитов переходит в мозговое вещество);
3) часть лимфоцитов возникает не в корковом веществе, а в мозговом. Тимус первого варианта близок к ЛУ, во втором варианте это относится к мозговому веществу тимуса, тогда как его корковое вещество напоминает селезенку в части путей поступления лимфоцитов в орган.
Заключение
В современных Международных анатомической и гистологической терминологиях основополагающим признаком объединения совершенно разных очагов кроветворения в единую лимфоидную систему стала их иммунопоэтическая функция, что представляется необоснованным с морфологической и с генетической точек зрения. Такую совокупность указанных органов и структур можно определять только как лимфоидный аппарат (подобная ситуация с эндокринными железами). Тем более, что красный костный мозг, лимфоидные бляшки, узелки и предузелки не являются самостоятельными органами. К собственно лимфоидным органам можно отнести тимус, ЛУ и, возможно, миндалины.
Лимфоидные элементы что это
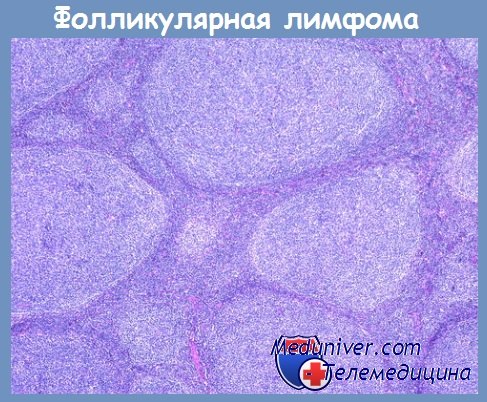
KILL: центробластно-центроцитарная; WF: фолликулярная преимущественно из маленьких клеток, из больших клеток и смешанная из маленьких и больших клеток.
Неопухолевыми аналогами опухолевых клеток при этой лимфоме являются клетки реактивных центров лимфоидных фолликулов: клетки с расщепленными (центроциты) и нерасщепленными (центробласты) ядрами. Первые небольшие, несколько крупнее малого лимфоцита, с мелкогранулярным хроматином, мелкими, плохо различимыми ядрышками и тонким ободком светлой цитоплазмы. Благодаря глубокой расщелине (выемке) ядра центроциты выглядят в гистологических препаратах угловатыми, вытянутыми.
Центробласты — крупные клетки, похожие на бласты. Ядра округло-овальные, светлые, ядрышки (2—3) локализуются у ядерной мембраны. Ободок цитоплазмы умеренно выраженный или широкий пиронинофильный и базофильный. Опухолевые клетки сохраняют способность к формированию фолликулоподобных (нодулярных) структур. Последние либо лишены зоны мантии, либо она узкая. Межфолликулярные прослойки различной ширины, чаще узкие. В них наблюдается «конденсация» ретикулиновых волокон, что особенно хорошо видно при импрегнации срезов серебром. По мере прогрессирования опухолевого роста фолликулоподобные очаги тесно прилежат друг к другу и, сливаясь, образуют поля диффузного роста.
Существует точка зрения, что диффузный рост является прогностически неблагоприятным фактором. Предлагают оценивать характер роста при фолликулярной лимфоме исходя из следующих критериев: если количество опухолевых фолликулов превышает 75 % от площади лимфатического узла, рост считать фолликулярным, при 25—75 % фолликулярным и диффузным; если фолликулы занимают менее 25 % от площади лимфатического узла, рост следует оценивать как преимущественно диффузный.
При диагностике фолликулярных лимфом учитывают клеточный состав опухолевых инфильтратов. Принято деление на лимфомы из преимущественно маленьких клеток (I цитологический тип), на смешанные — из маленьких и больших клеток (II цитологический тип) и из больших клеток (III цитологический тип). Это деление основывается на количественной оценке центробластов в опухолевых фолликулах в 10—20 полях зрения при большом увеличении микроскопа (х400).
При цитологическом типе I количество центробластов не должно превышать пяти в поле зрения, при II типе составляет от 6 до 15 центробластов и при III типе количество центробластов в поле зрения превышает 15. Клиническая целесообразность такого деления сомнительна, так как только фолликулярная лимфома с III типом клеточного состава прогностически неблагоприятна.
В фолликулярных лимфомах нередки очаги фиброза. Фолликулярная лимфома может иметь диффузный характер роста. Это наблюдается при различном клеточном составе. Наиболее часто встречается диффузная лимфома из маленьких клеток с расщепленными ядрами (центроцитарная). Высказываются сомнения в возможности существования в качестве самостоятельного варианта диффузной лимфомы смешанно-клеточного состава (из центроцитов и центробластов).
Не исключено, что диффузный рост — это результат опухолевой прогрессии фолликулярной лимфомы. Возможно, биопсии лимфатических узлов в других анатомических областях выявят фолликулярную форму роста.
Точка зрения о менее благоприятном течении диффузных лимфом из центрофолликулярных клеток нашла отражение в классификации WF, в которой они отнесены к опухолям промежуточной степени злокачественности.
Иммунофенотип фолликулярной лимфомы: CD5-, CD10+, CD19+, CD20+, CD22+, CD43-, CD79a+, BCL-2+, BCL-6+-, sIg (IgM+/-), ФДК CD21+ и CD23+ в виде четко организованной сети.
Цитологическая характеристика фолликулярной лимфомы. Клеточный состав представлен различными клетками:
1) прежде всего клетками с расщепленными ядрами — центроцитами (7—13 мкм). Центроцит — это клетка с неправильным светлым ядром, имеющим глубокую выемку, комковатую структуру хроматина без отчетливых ядрышек, с умеренно выраженной светлой или светло-базофильной цитоплазмой. Встречаются клетки с угловатыми ядрами, ядрами в виде гребешка, с «волнистыми» краями ядерной мембраны;
2) клетками с округло-овальными ядрами типа малых лимфоцитов;
3) бластными клетками с цитоморфологическими признаками центробластов.
При фолликулярной лимфоме I цитологического типа центробласты могут составлять до 20 % от всей опухолевой клеточной популяции, при II цитологическом типе — до 50 %, при III цитологическом типе — более 50 % опухолевых клеток.
Одним из характерных цитологических признаков фолликулярной лимфомы является присутствие в цитограмме пунктатов и мазков-отпечатков фолликулоподобных структур, что является отражением участков нодулярного характера роста. Фолликулоподобные структуры сформированы опухолевыми клетками, в их основе — «каркасные» фолликулярные дендритические клетки (ФДК).
ФДК визуализируется в пункционном цитологическом материале и мазках-отпечатках биопсированного лимфатического узла как одно- и двуядерные клетки с округло-овальными ядрами, имеющими нежную разреженную структуру хроматина, часто — отчетливое ядрышко и борозду в ядре, создающую впечатление «кофейного зерна», и широкую полигональную, реже — веретенообразную цитоплазму.
При фолликулярной лимфоме в цитограммах нередко встречаются многоядерные ФДК. В качестве «фона» препарата характерны цитоплазматические глобулы.
Дифференциальную диагностику проводят с другими вариантами мелкоклеточных В-клеточных лимфом и фолликулярной гиперплазией. При фолликулярной гиперплазии отмечаются лимфоидные элементы разной степени зрелости с наличием молодых форм, митозы в отдельных клетках; присутствуют макрофаги с признаками фагоцитоза, в том числе в фолликулоподобных структурах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лимфоидные элементы что это
В повседневной практике часто возникает необходимость в дифференциальной диагностике между реактивными изменениями лимфатических узлов, лимфомами и метастазами опухолей различного генеза [1, 2]. Тонкоигольная биопсия с последующим цитологическим исследованием достаточно часто используется в морфологической оценке увеличенных лимфатических узлов [3]. Методика является безопасной, простой и может быть использована многократно. Применение быстрых методов окрашивания цитологических препаратов позволяет в день взятия пункции получить предварительный диагноз и помогает направить больного к соответствующему специалисту для дальнейшего обследования. Цитологическое исследование обладает высокой достоверностью в диагностике метастазов рака, меланомы и других новообразований в лимфатических узлах, при этом у многих пациентов отпадает необходимость в диагностических биопсиях с гистологическим исследованием [4, 5]. Тем не менее роль цитологии в оценке лимфопролиферативных заболеваний считается не столь значительной. Ошибочная цитологическая диагностика носит характер как гипо-, так и гипердиагностики. Считается, что цитологическое исследование дает большое количество ложноотрицательных заключений при лимфоме Ходжкина и фолликулярных лимфомах (ФЛ) низкой градации. Кроме того, для назначения лечения при диагностировании фолликулярной лимфомы в настоящее время требуется определение ее варианта согласно классификации ВОЗ (2008) [6]. Дифференциальная цитологическая диагностика реактивных изменений лимфатических узлов и злокачественных лимфом не разработана. Однако недавние исследования показали, что точный диагноз лимфомы может быть получен при цитологическом исследовании в 85—90% случаев, если используются дополнительные современные технологии [7—12]. Цитолог в настоящее время может использовать такие современные методики, как иммунофенотипирование, которое проводится иммуноцитохимически либо методом проточной цитофлюориметрии, и молекулярно-генетические методы — флюоресцентная in situ гибридизация (FISH) и полимеразную цепную реакцию (ПЦР). С помощью иммуноцитохимии можно обнаружить моноклональную экспрессию опухолевыми клетками только одного из типов легких цепей иммуноглобулинов κ или λ. При проведении иммуноцитохимии, как правило, из-за выраженного фонового окрашивания, обусловленного тканевой жидкостью, применение этой методики ограничено. Предварительное отмывание опухолевых клеток перед проведением проточной цитофлюориметрии позволяет избавиться от фонового окрашивания и точно определить наличие клональности по легким цепям иммуноглобулинов κ или λ. Кроме того, молекулярно-генетическое исследование клональности В- и Т-лимфоцитов, включая саузерн-блот гибридизацию и ПЦР для обнаружения перестроек генов иммуноглобулинов и Т-клеточного рецептора, может успешно применяться к клеточному материалу, полученному при тонкоигольной биопсии. L. Skoog и E. Tani [13] показали, что цитологическое исследование лимфатических узлов, дополненное современными вспомогательными технологиями, имеет высокую точность в установлении лимфопролиферативных заболеваний и может исключить биопсию с последующим гистологическим исследованием. Применение FISH-метода в большинстве ФЛ и части диффузных В-клеточных крупноклеточных лимфом позволяет выявить транслокацию между 14-й и 18-й хромосомами, что проявляется иммуноцитохимически выраженной экспрессией протеина Bcl2 в В-клетках зародышевых центров.
Цель настоящего исследования — оценить возможности цитологического метода в дифференциальной диагностике между реактивными изменениями лимфатических узлов и злокачественными лимфомами, а также определить значение дополнительных методик (иммуноцитохимии, FISH), применяемых на цитологическом материале.
Материал и методы
Тонкоигольные аспирационные биопсии проводили у больных с измененными лимфатическими узлами в МНИОИ им. П.А. Герцена в период с 2010 по 2014 г. Все пункции лимфатических узлов выполнены под контролем УЗИ. Клеточный материал распределяли следующим образом: часть клеточного материала помещали на предметные стекла и готовили рутинные цитологические препараты, а другую часть клеточного материала помещали в специальную питательную среду накопления, находящуюся в микропробирке (800 мкл). Клеточный материал на предметных стеклах окрашивали азур-эозином. Суспензию клеток в микропробирке использовали при необходимости для иммуноцитохимии. Взвесь клеток распределяли по 50—100 мкл в контейнеры центрифуги Cytospin 4 и центрифугировали при 1000 об/мин в течение 5 мин. Контроль качества проводили окрашиванием двух цитоспиновых препаратов азур-эозином. При наличии в препаратах достаточного количества клеточного материала (200—300 клеток) проводили иммуноцитохимию, для чего использовали систему визуализации EnVision FLEX+.
В общей сложности цитологически было исследовано 549 лимфатических узлов. Из них в 235 (42,8%) выявлены метастазы рака или других злокачественных новообразований, в том числе меланомы. В 37 (6,7%) лимфатических узлах исследования оказались неинформативны. Реактивные изменения обнаружены в 213 (38,8%) лимфатических узлах и злокачественные лимфомы — в 64 (11,7%). Нами проанализированы результаты цитологического исследования тонкоигольных биоптатов 277 лимфатических узлов.
Диагностическую точность цитологического исследования тонкоигольной аспирационной биопсии оценивали путем сравнения с гистологическим исследованием. Больные, у которых диагностировали реактивные изменения лимфатических узлов, находились, как правило, под динамическим наблюдением не менее 1 года.
Для проведения дифференциальной цитологической диагностики между реактивными изменениями лимфатических узлов и лимфомами в качестве дополнительных исследований были использованы в 92 случаях иммуноцитохимия и в 61 — FISH. Иммуноцитохимию применяли для определения соотношения В- и Т-клеток, выявления клональности по легким цепям иммуноглобулинов и для определения подтипа лимфом, а FISH-исследование — для определения перестройки генов Bcl2, Bcl6, CCND1, c—MYC, связанных с определенными типами лимфом. Некоторые образцы не подлежали дополнительным исследованиям из-за недостаточности клеточного материала, что определялось на окрашенных монослойных цитоспиновых препаратах. Иммуноцитохимию проводили лишь на препаратах, где было не менее 200—300 клеток. При проведении иммуноцитохимии использовали следующую панель антител: CD45, CD20, CD19, CD79a, CD43, CD3, CD23, CD5, CD10, CD68, Bcl2, Bcl6, Ki-67, к легким цепям иммуноглобулинов κ и λ («Dako»). При подозрении на лимфому Ходжкина использовали антитела CD15 и CD30 («Dako»). Иммуноокрашивание антителами на цитокератины, виментин, белок S100 и HMB45 («Dako») проводили с целью дифференциальной диагностики между метастазами рака и меланомы. FISH использовали при подозрении на B-клеточную фолликулярную лимфому, в качестве уточняющей диагностики определяли перестройку гена Bcl2. Для диагностики диффузной В-клеточной крупноклеточной лимфомы определяли перестройку гена Bcl6 (3q27), лимфомы из клеток зоны мантии — CCND1 (11q13), лимфомы Беркитта — c—MYC (8q24).
В каждом случае определялось значение дополнительных методов для достижения конечного морфологического диагноза. Дополнительная методика считалась полезной, если подтверждался правильный диагноз.
Результаты
277 тонкоигольных аспирационных биоптатов (ТИАБ) получены от 260 больных. У 15 пациентов ТИАБ использовали 2 раза, и у одного — 3 раза. Корреляция между цитологическим диагнозом и окончательным клинико-гистологическим представлена в табл. 1.

В 64 биоптатах цитологически диагностированы лимфомы: из них в 53 диагноз был поставлен утвердительно, в 11 — подозрение на лимфому, причем 47 случаев представляли первичную диагностику лимфопролиферативных заболеваний, а 17 — рецидив заболевания после лечения. 48 препаратов были отнесены к неходжкинским лимфомам, из которых 46 определены как B-клеточные лимфомы на основе цитоморфологических и дополнительных исследований (иммуноцитохимия, FISH); в 2 случаях проведено лишь цитологическое исследование и поставлен диагноз неходжкинской лимфомы. В 16 случаях цитологически поставлен диагноз лимфомы Ходжкина. В 39 случаев цитологически утвердительно установленных неходжкинских лимфом и в 13 случаях лимфомы Ходжкина проведенные клинико-гистологические корреляции подтвердили цитологический диагноз.
Проведен анализ расхождений цитологических и гистологических данных. В одном случае цитологически установлена неходжкинская лимфома, а гистологически после биопсии — метастаз мелкоклеточного рака. В 11 случаях, где цитологически высказано подозрение на лимфому, при гистологическом исследовании лимфатических узлов в 9 случаях подтвержден диагноз лимфом: в 7 — ФЛ и в 2 — лимфома Ходжкина. Гистологическое исследование и клинические наблюдения в оставшихся двух подозрительных случаях показали реактивные изменения лимфатических узлов.
Гистологические и иммуногистохимические исследования проведены у 50 больных с неходжкинскими лимфомами. Гистологически и иммуногистохимически после биопсии установлены следующие диагнозы: ФЛ (24 случая), диффузная В-крупноклеточная лимфома (20 случаев), лимфома из малых лимфоцитов/хронический лимфоцитарный лейкоз (3 случая), лимфома из зоны мантии (1 случай), лимфома Беркитта (1 случай), Т-лимфобластная лимфома (1 случай). Биопсия лимфатических узлов выполнены в 17 случаях лимфомы Ходжкина. Гистологически во всех случаях установлен диагноз классической лимфомы Ходжкина различных подтипов: нодулярный склероз (11 случаев), смешанно-клеточный вариант (5 случая), обогащенный лимфоцитами (1 случай). Цитологические заключения сравнивали с клиническими и рентгенологическими данными о больных. Гистологическая диагностика, как правило, необходима для подтверждения цитологического заключения о наличии лимфомы и определения ее типа для назначения адекватного лечения.
Заметное увеличение лимфатических узлов можно отметить при таких процессах, как реактивная фолликулярная гиперплазия (рис. 1 и далее) в ответ на местные инфекции, ревматоидный артрит, системная красная волчанка и ВИЧ-инфекция, и паракортикальная гиперплазия, которая чаще всего сопровождает вирусные инфекции (такие, как инфекционный мононуклеоз), но может быть и в ответ на применение некоторых лекарств или вакцин. Во многих случаях реактивной гиперплазии присутствуют как фолликулярная, так и паракортикальная гиперплазия.

Клинические наблюдения соответствовали данным цитологической диагностики при реактивной лимфоидной гиперплазии лимфатических узлов в 181 случае из 213. У 32 пациентов с клинически подозрительной или длительно текущей лимфаденопатией проведена биопсия лимфатических узлов. Гистологически подтверждены реактивные изменения в 26 случаях, из которых 3 показали гранулематозный лимфаденит вследствие туберкулеза. Биопсия в 6 случаях выявила злокачественные лимфомы, и эти случаи были отнесены к ложноотрицательным. Отсутствие клеточного материала в достаточном количестве не позволило провести в этих случаях иммуноцитохимию и FISH, что в конечном счете привело к ошибке.
Большинство (202 случая) цитологически диагностированных реактивных лимфатических узлов в пунктатах характеризовалось лимфоидными элементами разной степени зрелости, встречались гистиоциты, эндотелий синусов (рис. 2). В 11 случаях определен клеточный состав гранулематозного воспаления. У 7 из этих больных в последующем клинически установлен туберкулез, у 4 из них его подтвердили положительными пробами на микобактерии туберкулеза.

При туберкулезе цитограмма пунктатов лимфатических узлов имела весьма специфическую картину — на фоне пролиферации лимфоидных элементов выявлялись единичные или в виде скоплений эпителиоидные клетки, многоядерные гигантские клетки Пирогова—Лангханса, синусовые клетки, лимфоциты и плазмоциты. Эпителиоидные клетки имели одно ядро овальной или округлой формы с сетчатым хроматином, ядрышки не определялись, цитоплазма без четких границ имела бледно-голубую окраску. Клетки Пирогова—Лангханса имели диаметр от 40 до 90 мкм и более, содержали многочисленные ядра вытянутой или овальной, эллипсовидной формы с нежнопетлистым хроматином. Ядра располагались преимущественно по периферии клетки. В некоторых ядрах различались ядрышки. Цитоплазма клеток слабобазофильная. У одного больного туберкулезом наблюдался казеозный некроз с дегенеративными изменениями и распадом клеток. Своеобразная клеточная картина позволила у одного больного установить диагноз саркоидоза, а у другого с двусторонней паховой лимфаденопатией серологически была установлена хламидийная инфекция.
При саркоидозе в цитологическом мазке обнаруживались эпителиоидные клетки, располагающиеся в структурах и разрозненно, клетки Пирогова—Лангханса, фибробласты, гистиоциты и лимфоциты, значительное количество клеток эндотелия синусов. При биопсии гистологически у одного больного подтвержден гранулематозный лимфаденит, установленный цитологически, связанный с реакцией на пыль у больного с силикозом. У последнего больного с гранулематозным лимфаденитом после гистологического исследования диагностирована лимфома Ходжкина, смешанно-клеточный вариант. Гиподиагностика произошла из-за отсутствия в цитологических мазках клеток Березовского—Штернберга.
В общей сложности в 61 случае имели место истинно положительные цитологические диагнозы лимфом, в 207 случаях — истинно отрицательные диагнозы реактивных лимфаденопатий, в 2 случаях — подозрение на наличие лимфомы (ложноположительные диагнозы лимфом), в 6 — ложноотрицательные и в одном случае неверное определение гистогенеза.
Для дифференциальной диагностики лимфом и реактивных изменений лимфатических узлов необходимо учитывать основные цитологические признаки лимфом: высокую клеточность препарата; «грязный» фон мазка; наличие большого количества «голых» ядер; нити ядерного детрита; «отшнурование» цитоплазматических глобул; мономорфность цитологической картины, однако иногда выявляются реактивные фоновые изменения; для бластных вариантов характерно наличие как полей сохранившихся, так и полуразрушенных бластных клеток, могут определяться митозы; при небластных вариантах лимфом в отличие от гиперплазий, характерны скопления «слепки» разрушенных опухолевых клеток, митозы не наблюдаются.
Анализ полученных данных показал, что при рутинной цитологической диагностике трудности возникали при дифференциальной диагностике фолликулярной гиперплазии и различных вариантов мелкоклеточных лимфом (ФЛ 1-й степени градации, лимфома из малых лимфоцитов и лимфома из клеток зоны мантии). Диагностике помогают знание особенностей цитограмм различных вариантов лимфом, определение иммунофенотипа и молекулярно-генетические данные.
Диагноз ФЛ правильно установлен цитологически у 21 из 24 больных с гистологически подтвержденными диагнозами. В 3 случаях имела место гиподиагностика, в одном случае — подозрение на ФЛ, не подтвержденную гистологически, и в одном случае — метастаз мелкоклеточного рака легкого. Цитологическая картина ФЛ представлена центроцитами и центробластами, относящимися к клеткам зародышевого центра. Кроме того, присутствовали фолликулярные дендритические клетки, Т-лимфоциты, но преобладали опухолевые В-клетки. Центроциты сравнивали с лимфоцитами, но они имели слегка больший размер, нежную структуру и равномерное распределение хроматина. Форма ядра изменена: угловатые, вытянутые с вдавлениями, с расщеплением и зазубренными контурами. Наблюдались центроциты со значительным расщеплением ядер, которые выглядели как расщепленный лепесток. Цитоплазма узкая бледно-голубая. Ядрышки встречались редко. Вторым типом опухолевых клеток являлись центробласты крупного и среднего размера, диаметром 12—15 мкм. Центробласты имели округлое либо овальное ядро с тонкопетлистой структурой хроматина, более светлой в центре и более грубой по краям, с наличием 2—3 ядрышек, расположенных под ядерной мембраной. Цитоплазма синего цвета и часто вакуолизирована. Доля центробластов варьировала.
В классификации ВОЗ (2008) [6] в зависимости от количества центробластов ФЛ подразделяются на 3 степени злокачественности. Таким образом, градации 1, 2 и 3 определяли по числу центробластов в 10 полях зрения на большом увеличении микроскопа (×40). При числе центробластов на 1 поле зрения 0—5 устанавливали 1-ю степень градации (рис. 3), 6—15 — 2-ю степень злокачественности и более 15 — 3-ю степень злокачественности. Подсчет осуществляли на цитологическом мазке. Особенно сложно проводить дифференциальную диагностику ФЛ 1-й степени злокачественности и фолликулярной гиперплазии лимфатического узла. Для Ф.Л., в отличие от фолликулярной гиперплазии, характерна монотонность клеточной картины, отсутствие макрофагов, синус-гистиоцитоза, митозов. Дифференциальная диагностика подкреплялась иммуноцитохимией: преобладанием опухолевых В-клеток, экспрессирующих пан-В-клеточные маркеры CD19, CD20 и CD79а, а также CD10. Иммуноцитохимически определялась экспрессия белка антагониста апоптоза Bcl2 (рис. 4), также экспрессировалась лишь одна из цепей иммуноглобулинов k или λ. Преобладание В-клеток, экспрессия Bcl2 и клональность по одной из легких цепей иммуноглобулинов k или λ позволяли проводить дифференциальную диагностику ФЛ и фолликулярной гиперплазии. Отсутствовала экспрессия CD5 и CD23 в опухолевых клетках. Эту особенность использовали для дифференциальной диагностики ФЛ и хронического лимфоцитарного лейкоза/В-клеточной лимфомы из малых лимфоцитов. В опухолевых клетках отсутствовала экспрессия Cyclin D1, что исключало лимфому из клеток мантии. Кроме того, нами был проведен анализ фракции пролиферирующих центроцитов и центробластов (Ki-67). Установлено, что эта цифра колеблется между 5 и 70% в зависимости от степени градации ФЛ.


Хронический лимфоцитарный лейкоз/В-клеточная лимфома из малых лимфоцитов установлены цитологически у 2 больных из 3, в одном случае произошла цитологическая гиподиагностика. У 75-летнего мужчины с плоскоклеточным раком гортани в анамнезе проведена тонкоигольная аспирационная биопсия увеличенных шейных лимфатических узлов справа. Цитограмма была расценена как реактивная лимфоидная гиперплазия без признаков метастазов. Иммуноцитохимия и FISH не были выполнены. Исследование периферической крови и костного мозга вскоре после этого показало наличие хронического лимфолейкоза. Пересмотр цитологических препаратов показал достаточно мономорфную клеточную популяцию, основной тип клеток составляли малые лимфоциты, имеющие скудную цитоплазму и округлое ядро с грубым комковатым хроматином, ядрышки не определялись (рис. 5). На этом фоне в небольшом количестве встречались и более крупные клетки среднего и крупного размера. Следует иметь в виду наличие варианта лимфомы из малых лимфоцитов с плазмоцитоидной дифференцировкой, при этом опухолевые клетки имеют ядра неправильной формы и более обильную цитоплазму. Иммунофенотип В-клеточной лимфомы из малых лимфоцитов характеризовался экспрессией пан-В-клеточных маркеров CD19, CD20 и CD79a, а также коэкспрессией CD5 и CD23. Преобладание В-клеток, экспрессия одной из легких цепей иммуноглобулинов k или λ позволили провести дифференциальную диагностику между хроническим лимфоцитарным лейкозом/В-клеточной лимфомой из малых лимфоцитов и фолликулярной гиперплазией. Отсутствие экспрессии CD10 отличает В-клеточную лимфому из малых лимфоцитов от ФЛ, а отсутствие экспрессии Cyclin D1 и наличие экспрессии CD23 позволяет исключить лимфому из клеток зоны мантии.

Лимфома из клеток мантии установлена у одного больного, данные цитологии и гистологии совпали. Цитограмма представлена клетками мелкого или среднего размера с неправильными контурами ядер, напоминающими центроциты (рис. 6). Хроматин умеренно плотный, ядрышки малозаметны. Центробласты и иммунобласты не встречались. В целом клеточная картина достаточно мономорфная и напоминала хронический лимфоцитарный лейкоз или лимфому из малых лимфоцитов. Следует иметь в виду, что существует несколько морфологических вариантов лимфомы из клеток мантии: бластоидный вариант и прочие. Разнообразие морфологических вариантов определяет необходимость проведения иммунофенотипирования для установления данного типа лимфомы. При проведении иммунофенотипирования клетки опухоли экспрессировали пан-В-клеточные антигены CD19, CD20 и CD79а, а также характеризовались наличием экспрессии CD5 и отсутствием CD23 и CD10, что позволило проводить дифференциальную диагностику с ФЛ и лимфомой из малых лимфоцитов. Иммуноцитохимически определялась гиперэкспрессия Cyclin D1 в ядрах опухолевых клеток.

Диффузная крупноклеточная В-клеточная лимфома установлена цитологически и гистологически у 16 больных. Цитограмма представлена различными крупными лимфоидными клетками, в среднем в 2 раза и более превышающими размер малого лимфоцита: центробластами, иммунобластами, клетками с многодольчатыми ядрами (рис. 7). Цитологически данный тип лимфомы отличался выраженным полиморфизмом, что позволило выделить несколько морфологических вариантов: центробластный, иммунобластный, лимфома с обилием Т-лимфоцитов и гистиоцитов, анапластический. Центробластный — опухоль состояла из крупных лимфоидных клеток с везикулярной структурой хроматина, 2—4 ядрышками, расположенными у ядерной мембраны, и умеренно развитой цитоплазмой, окрашенной базофильно. Иммунобластный — более 90% опухолевых клеток представлены иммунобластами, ядра которых имеют одно центрально расположенное крупное ядрышко и базофильную цитоплазму. Лимфома с обилием Т-лимфоцитов и гистиоцитов менее чем в 10% содержала опухолевые В-лимфоциты, имеющие вид центробластов, иммунобластов либо клеток, напоминающих клетки Березовского—Штернберга. При данном типе лимфомы важна как ее морфологическая диагностика, так и проведение иммунофенотипирования. Опухолевые клетки экспрессировали CD20, а реактивные малые Т-лимфоциты — CD3. Анапластический вариант представлен крупными овальными, круглыми, угловатыми клетками с плеоморфными ядрами, имеющими сходство с клетками Березовского—Штернберга. Цитограмма напоминала метастаз недифференцированного рака, отсутствие экспрессии цитокератинов позволило установить правильный диагноз. Иммунофенотип опухолевых клеток диффузной В-крупноклеточной лимфомы характеризовался экспрессией пан-В-клеточных антигенов — CD19, CD20, CD79a. При анапластическом варианте большинство клеток экспрессировали CD30, а в прочих вариантах он отсутствовал. 50% диффузных крупноклеточных В-клеточных лимфом экспрессировали CD10. Иммуноцитохимически во всех случаях Cyclin D1 отрицательный, отмечалась высокая пролиферативная активность, Ki-67 экспрессировали от 40 до 90% опухолевых клеток.


Паракортикальную гиперплазию, реактивные лимфатические узлы с гранулематозной реакцией и гранулематозные лимфадениты прежде всего следует дифференцировать с классической лимфомой Ходжкина и В- и Т-клеточными лимфомами с реактивными фоновыми изменениями.
Цитограмма при паракортикальной гиперплазии представлена мелкими зрелыми лимфоидными клетками, плазматическими клетками и небольшим количеством иммунобластов, которое варьировало (рис. 9). В редких случаях иммунобласты имели неровные контуры ядра и содержали ядрышки, что требовало проведения дифференциальной диагностики с лимфомой Ходжкина.

В нашем исследовании в одном случае цитологически неверно было высказано подозрение на лимфому Ходжкина при пункции лимфатических узлов на шее у больной 19 лет. В цитограмме на фоне лимфоидной гиперплазии присутствовали атипичные мононуклеары, иммунобласты, плазмоциты. После биопсии у пациентки при гистологическом исследовании до проведения иммуногистохимии также высказывалось подозрение на лимфому Ходжкина. После проведения иммуногистохимии был подтвержден вирусный лимфаденит, а именно инфекционный мононуклеоз, поскольку подозрительные клетки не экспрессировали CD30 и CD15.
У 15 из 17 больных цитологический диагноз лимфомы Ходжкина совпал с гистологией. У 1 больной было высказано предположение о наличии лимфомы Ходжкина и у 2 имела место гиподиагностика. Цитологически классическая лимфома Ходжкина имела достаточно характерную клеточную картину. В зависимости от варианта (нодулярный склероз, богатый лимфоцитами, смешанно-клеточный, лимфоидное истощение) изменялось реактивное клеточное окружение, но обязательным во всех случаях являлось наличие клеток Ходжкина и Березовского—Штернберга (рис. 10). Клетки Ходжкина достаточно крупные с большим светлым ядром, нежно-петлистой структурой хроматина, с четкими полиморфными увеличенными ядрышками. Многоядерные клетки Березовского—Штернберга имели размер 30—120 мкм, ядра округлые, неправильной формы, бобовидные, лопастные. Хроматин нежно-петлистый разреженный. Ядрышки крупные полиморфные, варьировали по числу, размеру, форме. Цитоплазма обильная базофильная, негомогенная, вакуолизированная. Иммунофенотип клеток Ходжкина и Березовского—Штернберга характеризовался коэкспрессией CD15 и CD30.

Таким образом, чувствительность и специфичность цитологической диагностики лимфом составила 91 и 95% соответственно. Общая точность цитологической дифференциальной диагностики между реактивной лимфаденопатией и лимфомой составила 97%.
В качестве дополнительных методов были выполнены иммуноцитохимические исследования 92 больным, FISH — 61 больному.
Иммуноцитохимия оказалась полезной в 80 из 92 случаев. Как правило, реактивные лимфатические узлы демонстрировали смешанную T- и B-популяцию клеток, где в большинстве случаев присутствовала разнотипная экспрессия легких цепей иммуноглобулинов. В В-клеточных лимфомах, как правило, иммуноцитохимически определялась экспрессия В-клеточных маркеров в доминирующих атипичных лимфоидных элементах, хотя Т-лимфоциты также присутствовали в различных количествах. Экспрессия лишь одного типа легких цепей иммуноглобулинов определялась в 1/3 В-клеточных лимфом. В тех случаях, когда иммуноцитохимически одновременно экспрессировались легкие цепи иммуноглобулинов κ и λ, оценить клональность невозможно. В 2 случаях, где в пунктате присутствовали мелкие однотипные злокачественные клетки, иммуноцитохимия позволила различить лимфомы из мелких клеток от мелкоклеточного рака. Клетки лимфомы экспрессировали общий лейкоцитарный антиген и не экспрессировали общие цитокератины, хромогранин, А и синаптофизин. Клетки Березовского—Штернберга экспрессировали CD15 и CD30 во всех случаях заболеваний лимфомой Ходжкина.
Иммуноцитохимия была бесполезной в 10 случаях тонкоигольных аспиратов. Недостаточное количество клеточного материала и фоновое окрашивание в 3 случаях не позволили установить диагноз ФЛ (ложноотрицательные случаи). В этих случаях в препаратах определялась смешанная В- и Т-клеточная популяция и иммуноцитохимически выявлялась коэкспрессия легких цепей иммуноглобулинов κ и λ.
FISH оказалась полезной в 59 случаях из 61. Для Ф.Л. характерна транслокация t (14;18) (q32;q21), сопровождающаяся перемещением онкогена Bcl2 в область гена, кодирующего тяжелую цепь иммуноглобулинов Ig, что приводит к гиперэкспрессии онкопротеина Bcl2. Блокирование апоптоза, связанное с гиперэкспрессией Bcl2, имеет решающее значение в патогенезе ФЛ. В нашем исследовании перестройка гена Bcl2 наблюдалась у 19 больных из 21 с ФЛ (табл. 2). В случае диффузной В-клеточной крупноклеточной лимфомы определяли перестройку гена Bcl6 (3q27). Лимфома из клеток зоны мантии характеризовалась перестройкой гена CCND1 (11q13), что иммуноцитохимически сопровождалось гиперэкспрессией онкопротеина Cyclin D1. Диагноз лимфомы Беркитта был подтвержден перестройкой гена c-MYC (8q24).

Различие между реактивными изменениями лимфатических узлов и злокачественными лимфомами является наиболее сложной областью цитологической диагностики. При этом гистологическое исследование удаленных лимфатических узлов в некоторых случаях также вызывает диагностические трудности. В случаях ФЛ высокой степени злокачественности и лимфом Ходжкина цитоморфологическая картина, как правило, очевидна и не вызывает сомнений, тогда как цитологическая диагностика лимфомы низкой степени злокачественности чаще всего основывается на присутствии относительно мономорфной лимфоидной клеточной популяции, в отличие от полиморфного клеточного состава лимфатического узла при реактивных изменениях. Таким образом, ошибочная цитологическая диагностика может быть в тех случаях, когда клеточный состав лимфомы представлен смешанным клеточным составом (ложноотрицательные случаи), либо при реактивных изменениях лимфатического узла с наличием атипичных клеток (ложноположительные случаи). По этим причинам большинство авторов выступают за проведение биопсии лимфатических узлов с гистологическим исследованием, чтобы подтвердить цитологический диагноз лимфомы. Тем не менее тонкоигольная аспирационная биопсия успешно используется для диагностики рецидива лимфомы или наличия лимфомы и исключения других, не связанных с лимфомой лимфаденопатий, получения клеточного материала из хирургически недоступных очагов или у больных с плохим общим состоянием.
В нашем исследовании у 8 (12%) из 67 больных не проводили биопсию лимфатических узлов для гистологического подтверждения цитологического диагноза лимфомы из-за плохого общего состояния этих больных. Тем не менее уточнение типа лимфом не требуется этим больным, так как у большинства из них возможно лишь симптоматическое лечение. Кроме того, цитологически и клинически диагностированные реактивные лимфоидные гиперплазии требовали консервативного лечения больных с лимфаденопатией и не требовали биопсии лимфатического узла.
В нашем исследовании проведено 549 тонкоигольных аспиратов лимфатических узлов, из них 277 (50,5%) оказались лимфаденопатиями, не связанными с метастазами. 12,2% (67 из 549) аспиратов составили лимфомы. Таким образом, более чем в половине случаев аспирационных биопсий требовалось проведение дифференциальной диагностики между злокачественными лимфомами и реактивными изменениями лимфатических узлов.
В 61 случае из 67 злокачественных лимфом были правильно определены цитологически. Анализ 6 ложноотрицательных результатов показал, что в 3 случаях ошибочно не установлены ФЛ, в 2 — лимфомы Ходжкина и в одном — хронический лимфолейкоз. Гиподиагностика в случаях ФЛ обусловлена тем, что цитологически клеточный состав был представлен лимфоидными элементами разной степени зрелости с наличием гистиоцитов, в связи с чем цитологически расценено как реактивные изменения, а не опухолевый процесс. Иммуноцитохимия была ошибочна в 3 случаях, поскольку показывала смешанную Т- и В-клеточную популяцию и клональность по легким цепям иммуноглобулинов не выявлялась. Таким образом, важно, что отрицательные результаты тонкоигольных аспирационных биопсий не исключают лимфомы у пациентов с неясными лимфаденопатиями и требуют повторной тонкоигольной биопсии или биопсии лимфатического узла с гистологическим исследованием в зависимости от клинических данных.
В 2 случаях ошибки отмечены при лимфоме Ходжкина. Лимфома Ходжкина цитологически не была установлена, так как в мазки не попали клетки Березовского—Штернберга, либо они были настолько редки, что маскировались доминирующим полиморфным клеточным инфильтратом, имитируя реактивную гиперплазию. Наличие эпителиоидных гранулем, как в одном из наших случаев, может также предположить инфекционн