Макрофагальная инфильтрация что это
Макрофагальная инфильтрация что это
а) Воспаление. При повреждении ткани независимо от его причины (бактерии, травма, химические агенты, тепло или любое другое явление) выделяется множество веществ, вызывающих существенные вторичные изменения в окружающих неповрежденных тканях. Весь комплекс этих тканевых изменений называют воспалением.
(1) расширением местных кровеносных сосудов с последующим избыточным местным кровотоком;
(2) увеличением проницаемости капилляров, что способствует утечке большого количества жидкости в интерстициальное пространство;
(3) часто — свертыванием жидкости в интерстициальном пространстве в связи с избытком фибриногена и других белков, вытекающих из капилляров;
(4) миграцией большого числа гранулоцитов и моноцитов в ткани;
(5) отеком тканевых клеток.
К тканевым продуктам, вызывающим эти реакции, относятся гистамин, брадикинин, серотонин, простагландины, несколько разных продуктов реакции системы комплемента, продукты реакции свертывающей системы крови и множество веществ, называемых лимфокинами, которые выделяются активированными Т-клетками (частью иммунной системы). Некоторые из этих веществ мощно активируют макрофагальную систему, и в течение нескольких часов макрофаги начинают уничтожать поврежденные ткани. Но иногда макрофаги повреждают еще живые тканевые клетки.
б) «Ограждающий» эффект воспаления. Одним из первых результатов воспаления является «ограждение» области повреждения от остальных тканей. Тканевые пространства и лимфатические сосуды в воспаленной области блокируются сгустками фибрина, поэтому через небольшой промежуток времени жидкость с трудом протекает через интерстиций. Этот процесс отгораживания задерживает распространение бактерий или токсических продуктов.
Интенсивность воспалительного процесса обычно пропорциональна степени повреждения ткани. Например, когда стафилококки проникают в ткани, они выделяют смертельно опасные клеточные токсины. В результате воспаление развивается быстро, гораздо быстрее, чем сами стафилококки могут размножиться и распространиться. Следовательно, для локальной стафилококковой инфекции характерно быстрое отгораживание, предохраняющее от распространения ее по телу.
Стрептококки, напротив, не вызывают такого интенсивного локального разрушения тканей. Следовательно, процесс отгораживания развивается медленно, на протяжении многих часов, в течение которых стрептококки успевают размножиться и мигрировать. В результате стрептококки часто проявляют гораздо более выраженную тенденцию к распространению в организме и развитию смертельных состояний, чем стафилококки, несмотря на то, что стафилококки гораздо более губительны для тканей.
Реакции макрофагов и нейтрофилов во время воспаления
Затем многие из ранее неподвижных макрофагов отделяются от мест их прикрепления и становятся мобильными, формируя первую «линию обороны» против инфекции в течение примерно первого часа. Количество этих рано мобилизуемых макрофагов часто незначительно, но они спасают жизнь.
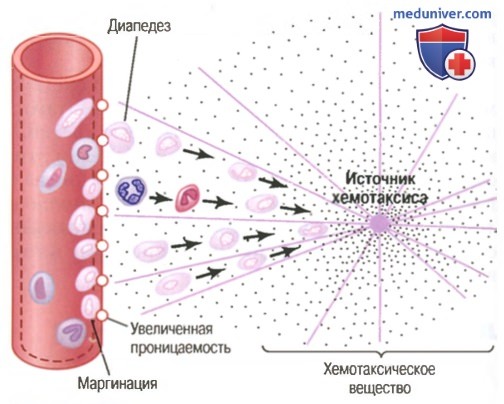
б) Вторжение нейтрофилов в воспаленную область является второй «линией обороны». В течение примерно первого часа после начала воспаления большое число нейтрофилов начинает внедряться в воспаленную область из крови. Этот процесс вызывается продуктами воспаленных тканей, которые инициируют следующие реакции:
(1) изменяют внутреннюю поверхность эндотелия капилляров, способствуя прилипанию нейтрофилов к стенкам капилляров в воспаленной области. Этот эффект, показанный на рисунке выше, называют маргинацией (или краевым стоянием лейкоцитов),
(2) ведут к разрыхлению сцеплений между эндотелиальными клетками капилляров и небольших венул, обеспечивая появление достаточно больших отверстий для прохождения нейтрофилов путем диапедеза непосредственно из крови в тканевые пространства;
(3) другие продукты воспаления вызывают хемотаксис нейтрофилов в направлении поврежденных тканей, как объяснялось ранее.
Таким образом, в течение нескольких часов после начала повреждения тканей область обильно заполняется нейтрофилами. Поскольку нейтрофилы крови — уже зрелые клетки, они готовы немедленно начать свои очистительные функции для уничтожения бактерий и удаления инородного материала.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфильтрат
Инфильтрат — это скопление в тканях организма клеточных элементов, несвойственных для этой области, а также крови и лимфы. Его формирование сопровождается увеличением ткани в объеме, она уплотняется, меняет цвет, в очаге ощущается болезненность.
Лечение и прогноз этого состояния зависят от вида и причины его возникновения:
В медицине выделяется еще несколько разновидностей этого состояния.
Представляет собой скопление различных клеток в легочной ткани. При этом ткань уплотняется, увеличивается в объеме, а работа органов дыхания затрудняется. Причина образования инфильтрата легкого — проникновение инфекции и паразитов (аскаридоз), развитие опухоли, аллергический процесс.
Для определения патологии решающую роль играет рентгенологическое обследование. Также назначаются анализы крови для определения природы болезни и возможных возбудителей.
Лечение зависит от причины патологии. Терапию назначает врач-пульмонолог.
Инфильтрат после операции — это осложнение, возникшее в результате хирургического вмешательства. Причина развития патологии — инфицирование и травматизация тканей.
Также возникновению инфильтратов способствует нарушение кровообращения в области вмешательства и сниженная сопротивляемость инфекциям в послеоперационном периоде.
Патология развивается постепенно. Она обнаруживается на первой или второй неделе после операции. У человека поднимается температура, появляются боли в области брюшной полости, возникает задержка стула. В области вмешательства врач определяет болезненное уплотнение.
Инфильтрат опасен остановкой затягивания послеоперационной раны и ее нагноением, поэтому сразу при его обнаружении хирург назначает антибиотикотерапию.
Патология развивается на месте подкожных или внутримышечных уколов. Чаще всего инфильтрат возникает после инъекций в ягодичную мышцу: появляется болезненность, при пальпации обнаруживается уплотнение. Кожа краснеет, температура поднимается до субфебрильных цифр.
Причиной развития становится нарушение правил постановки уколов (тупые иглы, быстрое введение препарата, частые инъекции в одну и ту же область, несоблюдение правил асептики).
Для лечения инфильтрата используются местные средства (йодная сетка), методы физиотерапии (электрофорез), УВЧ и антибиотикотерапия.
Это осложнение острого аппендицита, которое проявляется в виде спаянных между собой тканей аппендикса с органами, расположенными поблизости (слепая кишка, тонкая кишка, сальник).
Образование формируется на 2–5 день от начала болезни. После формирования инфильтрата острую боль в правой подвздошной области сменяет тупая и ноющая. В крови также определяется воспаление (повышенное СОЭ, лейкоцитоз). Температура поднимается до субфебрильных цифр. Со временем уплотнение может нагноиться или рассосаться. Образование лечится консервативным путем: врач назначает антибиотики, физиотерапевтические процедуры. Через 2 месяца проводится плановая аппендэктомия.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
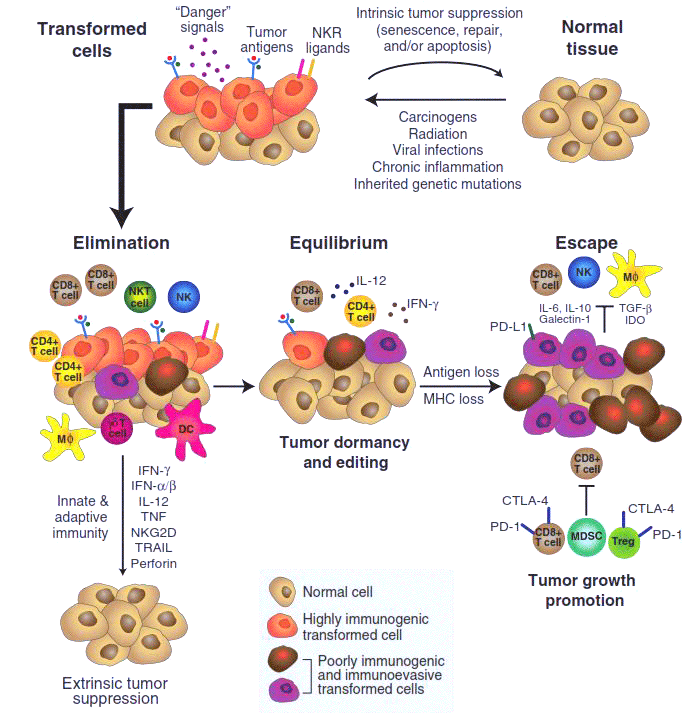
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
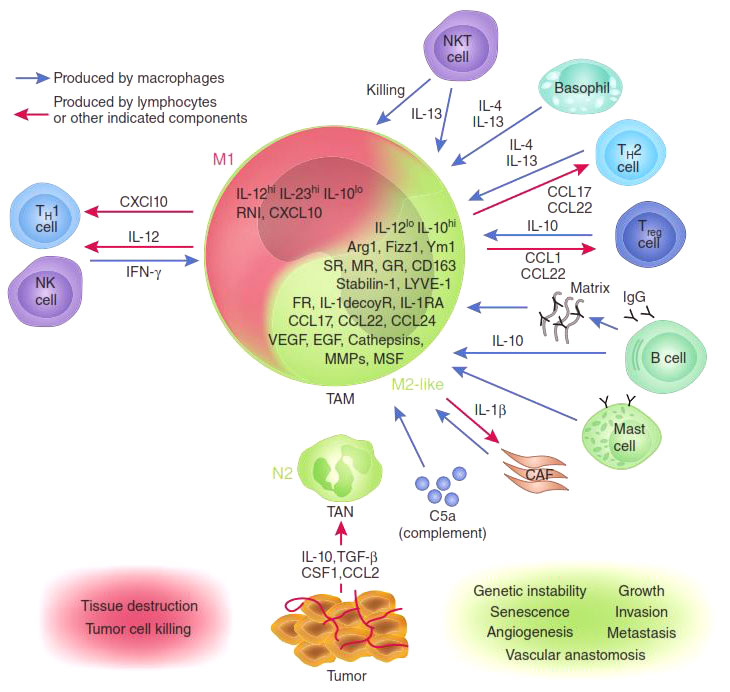
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Макрофагальная инфильтрация что это
Кафедра патологической анатомии Ростовского государственного медицинского университета, Ростов-на-Дону
Кафедра патологической анатомии Ростовского государственного медицинского университета, Ростов-на-Дону
Кафедра патологической анатомии Ростовского государственного медицинского университета, Ростов-на-Дону
Патоморфологическая диагностика эрозивно-язвенного рефлюкс-эзофагита по биопсии слизистой оболочки пищевода
Журнал: Архив патологии. 2012;74(6): 3-7
Дерижанова И. С., Головицкий В. Ф., Дерибас В. Ю. Патоморфологическая диагностика эрозивно-язвенного рефлюкс-эзофагита по биопсии слизистой оболочки пищевода. Архив патологии. 2012;74(6):3-7.
Derizhanova I S, Golovitskiĭ V F, Deribas V Iu. Pathomorphological diagnosis of erosive or ulcerative reflux esophagitis from esophageal mucosal biopsies. Arkhiv Patologii. 2012;74(6):3-7.
Кафедра патологической анатомии Ростовского государственного медицинского университета, Ростов-на-Дону
Изучены гистологические особенности и морфогенез острых пептических поражений слизистой оболочки при гастроэзофагеальной рефлюксной болезни на материале 2220 биопсий, полученных от 669 пациентов. Выделены стадии развития и два варианта заживления их, влияющие на продолжительность и исход заболевания. Показано, что острые эрозии и язвы в зонах многослойного плоского и цилиндрического эпителия представляют собой закономерный этап изменений, предшествующих развитию пищевода Барретта и способствующих его прогрессированию. Все описанные изменения должны найти отражение в гистологических заключениях по биоптатам слизистой оболочки пищевода, и их необходимо учитывать при назначении местного и общего лечения.
Кафедра патологической анатомии Ростовского государственного медицинского университета, Ростов-на-Дону
Кафедра патологической анатомии Ростовского государственного медицинского университета, Ростов-на-Дону
Кафедра патологической анатомии Ростовского государственного медицинского университета, Ростов-на-Дону
Актуальность проблемы гастроэзофагеальной рефлюксной болезни (ГЭРБ) обусловлена ее высокой распространенностью, которая, по данным ряда авторов, среди взрослого населения достигает 20—40% [1]. Особое место среди форм ГЭРБ занимают эрозивно-язвенные поражения, которые могут осложняться перфорацией, рубцовой стриктурой пищевода, приводить к медиастиниту и являться причиной смерти. Для их характеристики обычно используют эндоскопические классификации, учитывающие распространенность поражений к общей площади дистального отдела пищевода. Сведения о гистологической характеристике и морфогенезе острых язв и эрозий слизистой оболочки пищевода (СОП) остаются неполными [2, 3], в то время как аналогичные изменения в желудке и двенадцатиперстной кишке хорошо изучены и подробно описаны [4—6]. В то же время знание особенностей развития и заживления деструктивных поражений СОП под влиянием содержимого желудка и/или двенадцатиперстной кишки должно способствовать разработке особых методов лечения, с использованием, помимо антисекреторных, противовоспалительных препаратов и цитопротекторов слизистой оболочки, синергистов или антагонистов факторов роста.
Цель исследования — изучить морфологическую характеристику и морфогенез эрозивно-язвенных поражений при ГЭРБ.
В работе использовали материал 2220 биоптатов слизистой оболочки дистального отдела пищевода и области сквамозно-цилиндроклеточного соединения (СЦС) у 669 пациентов (у 90 больных проводились повторные исследования в динамике лечения ИПП). Гистологические препараты окрашивали гематоксилином и эозином, по Ван-Гизону, метиленовым синим по Лефлеру, комбинированным методом — алциановым синим и PAS-реакцией.
Пептические эрозии выявлены в 24% наблюдений, язвы — в 17%. Они, как правило, локализовались в области СЦС или зоны, выстланной многослойным плоским эпителием (МПЭ). При эрозиях дефекты ограничивались слизистой оболочкой до мышечной пластинки, для язв характерно было проникновение в подслизистый и мышечный слои. Микроскопически эрозии в биоптатах не всегда легко выявить в связи с тем, что они маскируются регенерирующим, резко утолщенным МПЭ. Нередко создается впечатление, что биоптат представлен только пластами эпителиоцитов. Лишь его тщательное исследование позволяет обнаружить едва заметные очаги некроза или скопления нейтрофилов рядом с МПЭ, свидетельствующие об остром процессе. Иногда при отслаивании МПЭ зоны некроза располагаются не на поверхности слизистой оболочки, а под эпителиальным пластом.
Отличительный признак острых пептических поражений — возникновение своеобразного некроза коллагеновых и мышечных волокон, который в литературе часто обозначают термином «фибриноидный» некроз. На самом деле в тех единичных случаях, когда удается увидеть начальные стадии повреждения СОП желудочным соком, типичной картины «фибриноида» не наблюдается. Покровный МПЭ обычно некротизируется и отслаивается на значительном протяжении пластами или ограниченно, с образованием узких щелевидных дефектов. В подлежащих слоях межуточное вещество соединительной ткани подвергается мукоидному набуханию, ядра клеток лизируются, в то время как контуры пучков коллагеновых и мышечных клеток сохраняются. Наблюдается резкое расширение сосудов, мультицентрический рост, с повышением проницаемости стенок и пропитыванием их фибрином. В дальнейшем некротические ткани приобретают вид гомогенных эозинофильных PAS-положительных, пикринофильных масс, лишенных клеточных элементов (рис. 1, а). 
Возможны два варианта заживления таких эрозий и язв.
В 27% наблюдений внутри или вокруг очагов некроза отмечалась выраженная лейкоцитарная инфильтрация с расплавлением некротических масс, их секвестрацией и отторжением (II стадия). В области краев или дна дефекта уже ко 2-м суткам можно увидеть новообразование капилляров и формирование грануляционной ткани. В биоптатах редко визуализируются все стадии процесса. Часто рядом с пластами МПЭ или изолированно обнаруживаются лишь очаговые скопления нейтрофилов, фибрина и/или некротических масс, указывающие на наличие острых пептических поражений.
Степень развития грануляционной ткани варьирует от очень мелких очагов в краях до обширных участков, занимающих всю площадь биоптата (рис. 1, б). Новообразованная молодая соединительная ткань представлена многочисленными сосудами капиллярного типа, иногда хорошо различимыми или невидимыми из-за обильной инфильтрации клеточными элементами. На поверхности грануляционной ткани видны скопления фибрина, лейкоцитов, а также микробов (чаще кокков), нити грибов типа Candida. При специальном окрашивании можно выявить характерный вертикальный ход капилляров к поверхности язвы. В глубоких отделах они располагаются параллельно поверхности дефекта и распространяются в мышечные слои. Эндотелий капилляров часто набухший, с крупными гиперхромными ядрами, на обычных препаратах приобретает сходство с опухолевыми клетками. Только использование специального окрашивания для выявления базальных мембран капилляров, а иногда и иммуногистохимических реакций позволяет выявить истинный характер изменений.
С момента повреждения начинается регенерация эпителиоцитов. В МПЭ происходят пролиферация клеток базального слоя (базально-клеточная гиперплазия), удлинение сосочков, что сопровождается значительным утолщением пласта; железистый эпителий в виде пласта смещается на эрозированную поверхность или грануляционную ткань. Нередко в эпителиоцитах желез, непосредственно граничащих с зоной повреждения, появляется смешанная желудочно-кишечная или кишечная слизь, интенсивно окрашивающаяся алциановым синим. Иногда на поверхности грануляционной ткани находятся группы недифференцированных клеток цилиндрического и многослойного плоского эпителия, лежащие изолированно друг от друга (стадия эпителизации; рис. 1, в). На этом фоне могут появляться островки более зрелого многослойного плоского эпителия с погружным ростом в грануляционную ткань или одиночные железы, выстланные цилиндрическими или бокаловидными клетками, содержащими PAS-положительную или смешанную (PAS-положительную и алцианофильную) слизь. Постепенно происходит полное закрытие дефектов сквамозным или цилиндрическим эпителием, которые иногда сосуществуют в виде изолированных островков или наслаиваются друг на друга. Поверхность эпителизированных дефектов ровная или ворсинчатая, с формированием полиповидных структур (рис. 1, г). Постоянно происходит новообразование слизистых оболочек желез. Заживление эрозий и язв занимает 4—8 нед. Таким образом, при эпителизации дефектов в 19% случаев возникает цилиндроклеточная метаплазия (ЦМ) сквамозного эпителия. В 74% наблюдений выявляется ЦМ кардиального типа: столбчатые клетки сходны с покровно-ямочным эпителием слизистой оболочки желудка, содержат в цитоплазме PAS+-слизь (рис. 1, д). В 26% наблюдений ЦМ расценена как кишечная. Во всех случаях она была неполной, сочеталась с ЦМ кардиального типа, имела разную распространенность (от отдельных бокаловидных клеток (БК) до крупных очагов с плоской или ворсинчатой поверхностью), наиболее обширной была в зоне СЦС, в краях глубоких язв (рис. 1, е). Помимо БК, в биоптатах обнаруживались и другие клеточные элементы кишечного типа: цилиндрические абсорбирующие с синей каймой, секретирующие с синей цитоплазмой, промежуточные клетки («тонко-толстокишечные», «желудочно-кишечные», «муцинозно-плоскоклеточные»). Количество БК возрастало с увеличением степени активности воспалительного процесса и снижалось при его затухании на фоне антисекреторной и противовоспалительной терапии. Таким образом формировался пищевод Барретта — участок ЦМ слизистой оболочки с кишечными бокаловидными и цилиндрическими клетками.
При хронизации язв в глубоких отделах отмечается фиброзная ткань, содержащая коллагеновые волокна, фибробласты, лимфоидные и макрофагальные инфильтраты. На вертикальном срезе можно различить три слоя: фибринозно-лейкоцитарный (внутренний), грануляционной и фиброзной ткани с выраженной воспалительной инфильтрацией.
Помимо описанного варианта заживления пептических эрозий и язв возможен второй путь — без развития типичной грануляционной ткани, за счет организации некротических масс, который встречался в 15% наблюдений. Его развитию, на наш взгляд, способствует лейкоцитарно-макрофагальная недостаточность. Плотные гомогенные пикринофильные некротические массы не подвергаются расплавлению и отторжению лейкоцитами, а окружаются фиброзной тканью, инкапсулируются. Со стороны неизмененных тканей в них врастают немногочисленные сосуды и фибробласты, расслаивая на глыбки, которые в дальнейшем подвергаются гиалинозу и окрашиваются фуксином в красный цвет (рис. 2, а). 
Острые поражения на фоне предсуществующей ЦМ МПЭ СОП поверхностны (рис. 2, в). Это свидетельствует о том, что ЦМ является своеобразной приспособительной реакцией организма в ответ на воздействие кислого желудочного или щелочного дуоденального содержимого. Небольшие очаги некроза слизистой оболочки инфильтрируются нейтрофилами и отторгаются. При регенерации железистого эпителия появляются БК (рис. 2, г), усиливается новообразование желез. Многие из них кистозно расширяются. В их эпителиальной выстилке также появляются элементы с кишечной слизью и типичные БК. При каждом обострении число элементов с кишечной слизью увеличивается. Так расширяется зона пищевода Барретта.
Помимо пептических эрозий и язв, могут возникать деструктивные процессы другого происхождения. Так, при желудочной метаплазии слизистой оболочки часть эрозий связана с повреждением эпителия Helicobacter pylori. Такие изменения характеризуются поверхностным расположением, инфильтрацией нейтрофилами при отсутствии зон некроза. По сравнению с пептическими поражениями слабо выражена реактивная гиперплазия слизистых оболочек желез. Возможно участие и других микроорганизмов. Инфицирование микробами и грибами, как правило, сопровождается выраженным гнойным воспалением, новообразованием лимфоидных фолликулов, HPV и HSV — своеобразными изменениями многослойного плоского эпителия.
Конечной стадией репарации при острых эрозивно-язвенных поражениях является ремоделирование слизистой оболочки и подслизистого слоя в виде формирования на поверхности акантом и папиллом, железистых гиперплазиогенных полипов, репликации мышечной ткани t. muscularis mucosae, склероза, гиалиноза, ангиоматоза.
При развитии рубцовых стенозов в биоптатах выявляется резкое утолщение МПЭ с папилломатозом, гиперкератозом, акантозом, выраженным гиалинозом подлежащей соединительной ткани.
Таким образом, по данным биопсий, эрозивно-язвенные поражения СОП были выявлены в 41% наблюдений, несмотря на то, что эндоскопию и забор материала проводили обычно после курса терапии ИПП. Наиболее тяжелые эрозивно-язвенные формы наблюдаются в области СЦС или в зонах МПЭ. Можно выделить 5 типичных стадий их развития — некроз, лейкоцитарную инфильтрацию и отторжение некротических масс, гранулирование, эпителизацию и ремоделирование тканей после рубцевания. Заживление язв — длительный процесс, занимающий не менее 4—8 нед.
Помимо классического варианта нами описан второй возможный путь репарации — инкапсуляция и организация некротических масс, превращение их в очаги гиалиноза. В этих случаях слабо выражены лейкоцитарная и макрофагальная инфильтрация, резко угнетен ангиогенез, вследствие чего не формируется богато васкуляризированная соединительная (грануляционная) ткань. Нарушается реэпителизация, в краях дефектов отмечается активная пролиферация клеток многослойного плоского и железистого эпителия, в окружающих тканях происходит гиперплазия слизистых оболочек желез. Именно на этом фоне часто регистрируется интестинальная метаплазия и создаются условия для формирования предопухолевых состояний.
При предсуществующей ЦМ острые деструктивные поражения СОП поверхностны. В процессе регенерации эпителия происходит кишечная метаплазия покровного и железистого эпителия. Так постепенно формируется пищевод Барретта.
Следовательно, острые эрозии и язвы, возникающие в зонах многослойного плоского и цилиндрического эпителия, представляют собой закономерный этап в цепи изменений, предшествующих развитию пищевода Барретта и способствующих его прогрессированию.
Учитывая частоту пептических поражений СОП, длительность заживления, возникающие грубые морфологические изменения, в комплекс лечебных мероприятий помимо антисекреторной терапии следует, по-видимому, включать противовоспалительные и цитопротекторные препараты.
Все стадии развития пептических эрозий и язв должны найти отражение в гистологических заключениях по биоптатам СОП, и их необходимо учитывать при назначении местного и общего лечения.