Макрофаги в цитологии молочной железы что это
Обследование при мастопатии, болях в молочной железе и др.
МАСТОПАТИЯ
– разнородная группа заболеваний молочной железы, возникающая, чаще всего, на фоне гормональных нарушений.
Проявляется в двух формах:
диффузная мастопатия – болезненное уплотнение ткани всей молочной железы, иногда сопровождающееся выделениями из соска (белыми, желтыми либо зеленоватыми);
узловая мастопатия – единичные или множественные узлы в молочной железе неправильной формы, с четкими границами. Диагностируются при маммографическом, ультразвуковом исследованиях и пункции узлов.
При планировании эффективного лечения мастопатии важно проведение полноценного обследования органов внутренней секреции, в том числе щитовидной железы. Такое лечение может и должен проводить только опытный гинеколог-эндокринолог.
КИСТА МОЛОЧНОЙ ЖЕЛЕЗЫ
– тонкостенная полость, содержащая жидкость. Диагностируется при маммографическом и ультразвуковом исследованиях, лечится посредством проведения пункции кистозной полости – удаления жидкости.
ГАЛАКТОЦЕЛЕ
– разновидность кисты, возникающая при кормлении грудью в связи с закупоркой млечного протока.
ГАЛАКТОРЕЯ
– выделение молока или молозива из сосков, не связанное с грудным вскармливанием. Галакторея чаще всего вызвана гиперпролактинемией (повышением в крови гормона пролактина). Причиной также может стать повышение уровня эстрогенов (женских половых гормонов).
У многих больных с незлокачественными заболеваниями наблюдаются выделения из сосков. Как правило, выделения небольшие, могут быть самого разнообразного цвета.
Особую тревогу вызывают кровянистые выделения, связанные с внутрипротоковой папилломой или раком молочной железы. С точки зрения онкологической настороженности, необходимо проводить обязательное цитологическое исследование этих выделений.
Патоморфолог может указать на наличие молозивных телец при галакторее, воспалительных изменений либо опухолевых клеток при раке.
ФИБРОАДЕНОМА
– доброкачественная опухоль, возникающая из клеток ткани молочной железы. Диагностируется при маммографическом и ультразвуковом исследованиях, для подтверждения диагноза необходима пункция опухоли.
Показанием к хирургическому удалению опухоли является ее прогрессирующее увеличение в объеме.
Разновидность фиброаденом – листовидная фиброаденома подлежит обязательному удалению, так как она может превратиться в саркому.
ЛИПОМА
– единичное, либо множественное, мягко-эластичное доброкачественное новообразование, которое формируется из жировой ткани. Чаще всего опухоли данного вида появляются в подкожно-жировой клетчатке.
Диагноз не вызывает затруднений.
Лечение, как правило, проводится при больших размерах опухоли, вызывающих косметический дефект.
ВНУТРИПРОТОКОВАЯ ПАПИЛЛОМА
– доброкачественная опухоль из клеток стенки протока, растущая внутри протока. Симптомом внутрипротоковой папилломы является выделение из соска прозрачной, «янтарной» или кровянистой жидкости. Диагностируется при специальном рентгенологическом исследовании – дуктографии и исследовании выделений под микроскопом.
Внутрипротоковая папиллома подлежит обязательному хирургическому удалению, так как из нее может развиться злокачественная опухоль.
МАСТИТ
– инфекционное либо асептическое воспаление ткани молочной железы, дифференцируется с диффузными и воспалительными формами рака.
ЖИРОВОЙ НЕКРОЗ (ОЛЕОГРАНУЛЕМА)
– вариант завершения воспалительного процесса или травмы молочной железы (иногда возникает после хирургического лечения или проведения лучевой терапии). Плотное узловое образование неправильной формы, дающее симптомы, сходные с узловыми формами рака молочной железы.
ГИНЕКОМАСТИЯ
– увеличение грудных желез у мужчин из-за гипертрофии железистой ткани.
Развитие гинекомастии связано с избытком (превышением) эстрогенов по отношению к тестостерону.
От гинекомастии необходимо отличать избыточное развитие жировой ткани в области ареолы (ложная гинекомастия).
Для подтверждения диагноза гинекомастии используются маммография и ультразвуковое исследование.
Лечение необходимо проводить с учетом патогенетического механизма развития заболевания (лечение заболеваний печени, щитовидной железы, отмена медикаментов …). Больным с прогрессивно увеличивающейся гинекомастией, неподдающейся терапии эндокринных нарушений, показано хирургическое лечение – трансареолярная мастэктомия.
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
– злокачественная опухоль. Выделяют диффузные и узловые формы рака молочной железы.
Узловые формы рака при небольших размерах опухоли клинически похожи на любое узловое образование, чаще всего на узловую мастопатию.
Диффузные формы труднее при клинической диагностике.
К особым формам относятся маститоподобные, рожистые и отечно-инфильтративные формы.
РАК ПЕДЖЕТА
– локализуется в области ареолы и соска, по виду напоминает экзему.
При прогрессировании заболевания сосок разрушается и на его месте возникает язвенная поверхность.
Чем опасен рак молочной железы?
Если не лечить, опухоль увеличивается, прорастает в кожу и грудную стенку, поражает ближайшие лимфоузлы. В других органах (легких, печени, костях, головном мозге) могут появиться отдаленные метастазы.
Придя в кабинет врача-онколога, Вам нужно будет пройти клинический осмотр.
Сначала врач опросит Вас и уточнит необходимые данные из Вашего анамнеза – то есть из истории заболевания, в основном акцентируя внимание на факторах риска.
Затем врач проведет пальпацию, то есть ощупывание молочных желез. Во время клинического обследования врач попросит вас принять различные положения – поднять руки, положить их на плечи врачу. Это делает более доступными для пальпации грудь и подмышечную впадину. В ряде ситуаций необходимо проведение пальпации не только в положении стоя, но и лежа на кушетке.
Врач проверит состояние сосков и ареол, а также наличие выделений из сосков. При появлении выделений из сосков врач-онколог возьмет мазок этих выделений для цитологического исследования.
Врач-онколог выберет оптимальную для Вас комбинацию основных методов лучевой диагностики заболеваний молочной железы, то есть маммографии и УЗИ, оценив показания и противопоказания к каждому из них.
На повторном приеме врач-онколог сопоставит результаты лучевых методов исследования с клинической картиной и определит тактику дальнейшего наблюдения и лечения. При необходимости врач-онколог совместно с врачом-рентгенологом или врачом ультразвуковой диагностики проводит биопсию.
Тревожные симптомы
Заметили хотя бы один из вышеперечисленных признаков? Обратитесь к онкологу-маммологу. Если в Вашей поликлинике нет онколога-маммолога, обратитесь к терапевту, гинекологу или хирургу. Они проведут предварительный осмотр и дадут направление в онкологический диспансер или специализированную клинику.
Записаться на консультацию:
+7 (916) 757 80 54
Филиал №1 Клиники женского здоровья МКНЦ (г. Москва, ул. Гончарная, д. 23)
+7 (916) 757 80 05
Филиал №2 Клиники женского здоровья МКНЦ (г. Москва, Верхний Предтеченский пер., д. 8)
Иммунные клетки помогают перестраиваться молочной железе
Когда молочной железе становятся ненужными некоторые протоки, образовавшиеся в период вскармливания, их съедают местные иммунные клетки.
Когда приходит время кормить молоком детёныша, молочные железы меняются – в них разрастаются молочные протоки, собирающие молоко от скоплений железистых клеток. Когда период вскармливания заканчивается, молочная железа снова меняется: разветвлённые многочисленные протоки исчезают, их клетки отмирают. Естественно, всё это подчиняется гормональным сигналам, однако в самой железе должны быть механизмы, обеспечивающие такие перестройки в структуре.
Исследователи из Медицинского института Уолтера и Элизы Холл вместе с коллегами из Мельбурнского университета сообщают в Nature Cell Biology, что им удалось обнаружить клетки, которые помогают избавиться молочной железе от лишних протоков. Это макрофаги – иммунные клетки, которые есть во многих органах и тканях; они активно ползают между другими клетками, образующими орган, и в буквальном смысле поедают всё подозрительное и ненужное: бактерий, вирусы, молекулярные обломки, оставшиеся от погибших клеток, и т. д. Макрофаги, обслуживающие конкретный орган, называют резидентными макрофагами – если не случается ничего чрезвычайного, они свой орган не покидают.
Авторы работы утверждают, что те макрофаги, которые обнаружились в молочной железе – это новая их разновидность, до сих пор никому не известная. Звездообразные макрофаги сидят в молочных протоках, они малоподвижны, стиснуты между двумя слоями клеток, и образуют что-то вроде сети. Когда клетки протоков начинают отмирать за ненадобностью, макрофаги протягивают к ним свои «руки»-отростки и поедают их. То есть новые макрофаги помогают молочной железе вернуться в некормящее состояние. Никакие другие иммунные клетки эту работу делать не могут: когда местные макрофаги удаляли из протоков молочной железы, ненужные клетки оставались несъеденными.
Притом макрофаги должны понимать, когда молочные протоки нужно уничтожать и когда не нужно. Рак молочной железы, одна из самых распространённых злокачественных опухолей, начинается с клеток протоков молочной железы, и, по словам исследователей, число макрофагов увеличивается по мере роста опухоли. Иммунитет должен уничтожать раковые клетки, но, возможно, макрофаги мешают другим иммунным клеткам делать своё дело, потому что полагают, что сейчас просто настало время молочной железе разрастаться.
Возможно, опухоли груди будет легче лечить, если найти способ если как-то подействовать на эти грудные макрофаги, сделать так, чтобы они мешали другим иммунным клеткам атаковать раковые клетки, а ещё лучше – чтобы они сами начали их уничтожать.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
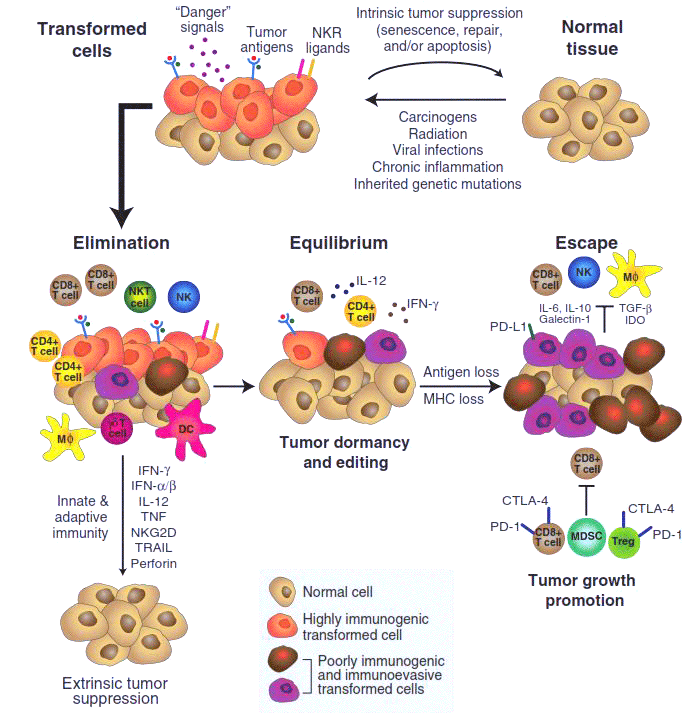
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
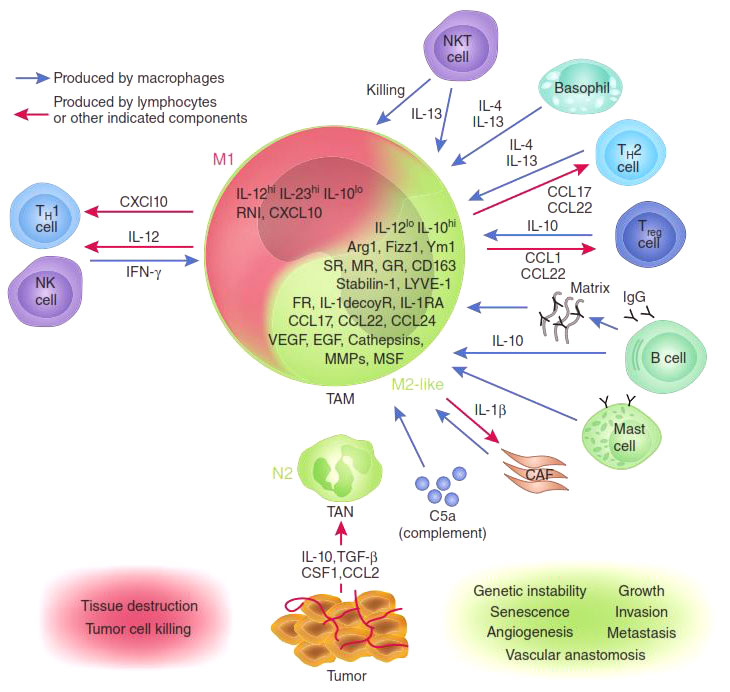
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Цитологическая диагностика заболеваний молочной железы
Показанием к цитологическому исследованию служат узловые образования в молочной железе, наличие выделений из соска, эрозивных или язвенных поверхностей. Выявление узловых образований возможно при пальпации, ультразвуковом исследовании, маммографии.
Особенно важно выполнять пункцию узловых образований молочной железы, в т. ч. непальпируемых, при наличии факторов риска рака, к которым относится: возраст (женщины старше 40 лет), нарушение гормонального баланса, раннее начало менструаций (раньше 12 лет) и позднее окончание (позже 50 лет), отсутствие родов и кормления ребенка, избыточная жировая клетчатка, особенно при быстром наборе веса, в сочетании с гиперплазией эпителия протоков, генетические особенности – наиболее часто предрасположенность к раку молочной железы и яичников передается по материнской линии (ген BRCA1), нарушение менструального цикла вследствие длительного лечения гормонами, особенно эстрогенами, наличия гормонально активных опухолей яичника и эндометрия, гормональная контрацепция при неправильном применении и гормональная заместительная терапии в климактерическом периоде, рентгеновское облучение.
Получение материала
Материал получают с помощью диагностической пункции – тонкоигольной аспирационной биопсии (ТАБ), отпечатков с трепанобиоптата (core biopsy) или эрозивных поверхностей, при наличии выделений из соска – сцеживания отделяемого. Возможна также интраоперационная диагностика по соскобу с ткани (или опухоли) молочной железы, удаленной во время операции.
Если предполагается использовать метод жидкостной цитологии и/или дополнительные молекулярные исследования – после ТАБ и приготовления стандартного мазка для получения клеточной суспензии иглу промывают в небольшом количестве стабилизирующего раствора, предназначенного для соответствующего исследования, в контейнере (или пробирке типа Эппендорф).
Приготовление препаратов
При получении небольшого количества жидкости (из кист, выделений из соска), препараты готовят как мазки крови: каплю выделений помещают на стекло, каплю из иглы выдувают, и с помощью специального стекла с шлифованным краем или пластикового шпателя для приготовления мазков крови делают препарат. Капля следует (тянется) за стеклом (шпателем) до образования на крае препарата “щеточки”, которой заканчивается мазок.
При наличии объемных жидкостных образований весь полученный материал помещают в пробирку и доставляют в лабораторию. При получении жидкости она должна быть полностью эвакуирована; в этом случае пункция молочной железы может быть и диагностической и лечебной процедурой. Наличие прозрачной жидкости чаще всего свидетельствует о доброкачественном процессе (кистозной полости). Мутная или кровянистая жидкость является достаточно серьезным основанием к поиску признаков опухолевого процесса. Любая полученная жидкость должна быть исследована цитологическим методом.
Жидкий материал или клеточная суспензия в контейнере (жидкостная цитология) подлежат дальнейшей обработке в лаборатории. Можно готовить “традиционные” мазки из жидкостей после их центрифугирования или стандартные тонкослойные препараты методом жидкостной цитологии. Если клеточная суспензия богата материалом, а также содержит небольшие клочки ткани, возможно приготовление из нее клеточных блоков (цитоблоки, вариант гистологического исследования).
Окрашивание можно проводить любым методом. При необходимости выполняют молекулярное исследование (проточная цитометрия, иммуноцитохимическое, молекулярно-генетическое исследования и др.).
Трактовка цитологического заключения
Цитологическое заключение о гиперплазии эпителия молочной железы (с предположительным или уверенным заключением о кисте, фиброзно-кистозной болезни или фиброаденоме) позволяет клиницисту планировать лечебную тактику.
При уверенном заключении о злокачественном процессе, установленном квалифицированными специалистами, цитологический диагноз может служить основанием для планирования лечения. При необходимости цитологический диагноз дополняется молекулярными исследованиями.
Если врач-цитолог не может судить о патологическом процессе вследствие недостаточного количества материала, некротических изменений и других причин, желательно повторить ТАБ с более тщательным выбором участка для пункции, нескольких пассов иглой в разных направлениях.
При цитологическом диагнозе дисплазии, тяжелой дисплазии, гиперплазии с атипией (или гиперплазии с атипией отдельных клеток), а также при предположительном цитологическом заключении о злокачественном процессе при небольшом количестве клеточного материала, возможно уточнение диагноза с помощью повторной пункции тонкой иглой или гистологического исследования (трепанобиопсия или секторальная резекция со срочным гистологическим исследованием).
Интеграция различных лабораторных методов
Определение рецепторов эстрогенов и прогестерона, рецепторов HER2/neu в пунктатах молочной железы – исследования, которые при раке молочной железы должны быть выполнены у каждой больной для определения лечебной тактики.
Опухоли с наличием рецепторов к эстрогенам отличаются хорошим прогнозом, ответом на гормональную терапию. Опухоли с положительной реакцией на HER2/neu и отрицательной на рецепторы эстрогенов отличаются плохим прогнозом и низкой продолжительностью жизни, однако возможен хороший ответ на таргетную терапию трастузумабом. Рак с базальноклеточным фенотипом и отрицательной реакцией на рецепторы эстрогенов характеризуется плохим прогнозом, низкой продолжительностью жизни и отсутствием ответа на терапию.