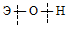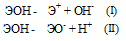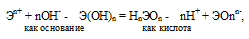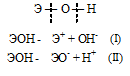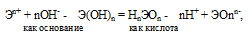Металлические свойства хрома выражены сильнее чем у
Правильное составление формул веществ хрома, селена, мышьяка, ванадия, серы, азота, углерода, сурьмы
Ванадий d-элемент VВ- группы, а мышьяк – р-элемент VА- группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Эти атомы обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка.
Задание 48.
Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
Решение:
Марганец в своих соединениях проявляет степень окисления +2, +3, +4, +6, +7.
Формулы оксидов, отвечающих этим степеням окисления:
Формулы гидроксидов марганца:
Mn(OH)2 – гидроксид марганца(II);
Mn(OH)3 – гидроксид марганца(III);
Mn(OH)4 – гидроксид марганца(IV);
H2MnO4 – марганцовистая кислота;
HMnO4 – марганцовая кислота.
Mn(OH)4 – гидроксид марганца(IV) – амфотерное основание, которое реагирует как с кислотами, так и со щелочами:
Хром d-элемент VIВ- группы, а селен – р-элемент VIА – группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять их. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома сильнее выражены, чем у селена. К тому же селен, присоединив два электрона к наружному р-подуровню, проявляет отрицательную степень окисления и образует с водородом газообразное соединение H2Se, которое называют селеноводород.
Формулы соединений алюминия с данными элементами в этой степени окисления:
AlCl3 – хлорид алюминия;
Al2S3 – сульфид алюминия;
AlN – нитрид алюминия;
Al4C3 – карбид алюминия.
+15Р 1s 2 2s 2 2p 6 3s 2 3p 3 ; +51Sb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 3
На внешнем энергетическом уровне оба элемента содержат по пять валентных электронов, из которых два s-и три р-электрона.
Так как фосфор – элемент третьего периода, а сурьма – пятого, то из этого следует, что радиус атома фосфора значительно меньше, чем у атома сурьмы. В группах с увеличением порядкового номера элементов закономерно увеличиваются радиусы их атомов, что приводит к уменьшению связи внешних электронов; поэтому атом фосфора обладает определённым сродством к электрону, и, следовательно, приобретает отрицательную степень окисления и имеет больше шансов образовывать отрицательные ионы. Таким образом, фосфор, как все неметаллы, обладает только очень слабыми восстановительными свойствами и более сильными окислительными функциями. Сурьма, имея большие размеры атома, будет легче отдавать электроны внешнего энергетического уровня, чем принимать и поэтому будет проявлять восстановительные функции, т. е. обладать характерными металлическими свойствами.
Задание 52.
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(OH)2; Ca(OH)2 или Fе(ОН)2; Сd(ОН)2 или Sr(OH)2.
Решение:
Гидроксиды можно изобразить общей формулой ЭОН, где Э – металл. Гидроксиды могут диссоциировать по схеме:
Диссоциация зависит от прочности и полярности связей Э — О и О — Н и может протекать по двум направлениям:
Задание 53.
Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuОН Или Сu(OH)2; Fе(ОН)2 или Fе(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение:
Если данный элемент проявляет переменную степень окисления (валентность) и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства послед-них меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э — О и О — Н может протекать по двум направлениям:
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Диссоциация по кислотному типу (II) протекает, если
ЕО—Н > ЕЭ—О (низкая степень окисления).
Если прочности связей Э — О и О — Н близки или равны, то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
Отсюда вытекает, что гидроксид меди (I) CuOH более сильное основание, чем гидроксид меди (II) Cu(OH)2; а Fe(OH)2 более сильное основание, чем Fe(OH)3; Sn(OH)2 более сильное основание, чем Sn(OH)4.
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Правильное составление формул веществ хрома, селена, мышьяка, ванадия, серы, азота, углерода, сурьмы
Ванадий d-элемент VВ- группы, а мышьяк – р-элемент VА- группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Эти атомы обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка.
Задание 48.
Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
Решение:
Марганец в своих соединениях проявляет степень окисления +2, +3, +4, +6, +7.
Формулы оксидов, отвечающих этим степеням окисления:
Формулы гидроксидов марганца:
Mn(OH)2 – гидроксид марганца(II);
Mn(OH)3 – гидроксид марганца(III);
Mn(OH)4 – гидроксид марганца(IV);
H2MnO4 – марганцовистая кислота;
HMnO4 – марганцовая кислота.
Mn(OH)4 – гидроксид марганца(IV) – амфотерное основание, которое реагирует как с кислотами, так и со щелочами:
Хром d-элемент VIВ- группы, а селен – р-элемент VIА – группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять их. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома сильнее выражены, чем у селена. К тому же селен, присоединив два электрона к наружному р-подуровню, проявляет отрицательную степень окисления и образует с водородом газообразное соединение H2Se, которое называют селеноводород.
Формулы соединений алюминия с данными элементами в этой степени окисления:
AlCl3 – хлорид алюминия;
Al2S3 – сульфид алюминия;
AlN – нитрид алюминия;
Al4C3 – карбид алюминия.
+15Р 1s 2 2s 2 2p 6 3s 2 3p 3 ; +51Sb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 3
На внешнем энергетическом уровне оба элемента содержат по пять валентных электронов, из которых два s-и три р-электрона.
Так как фосфор – элемент третьего периода, а сурьма – пятого, то из этого следует, что радиус атома фосфора значительно меньше, чем у атома сурьмы. В группах с увеличением порядкового номера элементов закономерно увеличиваются радиусы их атомов, что приводит к уменьшению связи внешних электронов; поэтому атом фосфора обладает определённым сродством к электрону, и, следовательно, приобретает отрицательную степень окисления и имеет больше шансов образовывать отрицательные ионы. Таким образом, фосфор, как все неметаллы, обладает только очень слабыми восстановительными свойствами и более сильными окислительными функциями. Сурьма, имея большие размеры атома, будет легче отдавать электроны внешнего энергетического уровня, чем принимать и поэтому будет проявлять восстановительные функции, т. е. обладать характерными металлическими свойствами.
Задание 52.
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(OH)2; Ca(OH)2 или Fе(ОН)2; Сd(ОН)2 или Sr(OH)2.
Решение:
Гидроксиды можно изобразить общей формулой ЭОН, где Э – металл. Гидроксиды могут диссоциировать по схеме:
Диссоциация зависит от прочности и полярности связей Э — О и О — Н и может протекать по двум направлениям:
Задание 53.
Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuОН Или Сu(OH)2; Fе(ОН)2 или Fе(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение:
Если данный элемент проявляет переменную степень окисления (валентность) и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства послед-них меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э — О и О — Н может протекать по двум направлениям:
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Диссоциация по кислотному типу (II) протекает, если
ЕО—Н > ЕЭ—О (низкая степень окисления).
Если прочности связей Э — О и О — Н близки или равны, то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
Отсюда вытекает, что гидроксид меди (I) CuOH более сильное основание, чем гидроксид меди (II) Cu(OH)2; а Fe(OH)2 более сильное основание, чем Fe(OH)3; Sn(OH)2 более сильное основание, чем Sn(OH)4.
| 🎓 Заказ №: 22234 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Решение: Электронные формулы данных элементов: 2 2 6 2 6 1 5 24Cr 1s 2s 2p 3s 3p 4s 3d 2 2 6 2 6 2 10 4 34 Se 1s 2s 2p 3s 3p 4s 3d 4p Хром – d-элемент VIIIB-группы, а селен – p-элемент VIA-группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, тенденцией
Готовые задачи по химии которые сегодня купили:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Газообразное соединение с водородом?
Ответ мотивируйте исходя из строения атомов хрома или селена.
хром не образует газообразного соединения с водородом.
Соединения состава Na2ЭО4 образует каждый из двух элементов :1) селен и бром2) фосфор и хлор3) хром и фосфор4) сера и хромПомогите и объясните пожалуйста : )?
Соединения состава Na2ЭО4 образует каждый из двух элементов :
Помогите и объясните пожалуйста : ).
Обьясните строение атомов хрома и железа?
Обьясните строение атомов хрома и железа.
Исходя из строения атомов поясните у какого элемента ярче выражены неметаллические свойства и почему : C и Se?
Исходя из строения атомов поясните у какого элемента ярче выражены неметаллические свойства и почему : C и Se.
Какое строение имеют атомы элементов Серы и Хрома?
Какое строение имеют атомы элементов Серы и Хрома.
Поясните, где они расположены в ПСХЭ(Периодическая Система Хим.
Элементов), и почему?
У какого элемента сильнее выражены металлические свойства Ca или Zn?
У какого элемента сильнее выражены металлические свойства Ca или Zn.
Помогите с решением задачи : сера и хром находятся в VI группе Периодической системы?
Помогите с решением задачи : сера и хром находятся в VI группе Периодической системы.
Почему хром проявляет восстановительные (металлические), а сера – окислительные (неметаллические) свойства?
Нужен обоснованный ответ, исходя из электронного строения атомов этих элементов, величины их электроотрицательности.
К каким электронным семействам принадлежат сера и хром?
Имеют ли атомы этих элементов возбужденные состояния?
Ответ необходимо подтвердить, написав их электронные схемы.
Чем объясняется «провал» электрона у атома хрома?
Помогите, объясните, почему хром проявляет восстановительные (металлические), а сера – окислительные (неметаллические) свойства?
Помогите, объясните, почему хром проявляет восстановительные (металлические), а сера – окислительные (неметаллические) свойства?
Нужен обоснованный ответ, исходя из электронного строения атомов этих элементов, величины их электроотрицательности.
К каким электронным семействам принадлежат сера и хром?
Имеют ли атомы этих элементов возбужденные состояния?
Ответ подтвердить, написав их электронные схемы.
Чем объясняется «провал» электрона у атома хрома?
W = n * Ar / Mr H2O W (H) = 2 * 1 / 18 = 0, 11 (11%) NH3 W(H) = 3 * 1 / 17 = 0, 18 (18%) CH4 W(H) = 4 * 1 / 16 = 0, 25 (25%) В порядке возрастания W(H) : H2O, NH3, CH4.
Це скільки атомів має відповідний елемент в речовині Наприклад : С2Н6 у цій речовині два атоми карбону і шість атомів гідрогену.