Метронидазол и дазолик в чем разница
Применение метронидазола, тинидазола, ниморазола, тенонитрозола, орнидазола в лечении больных с хроническим урогенитальным трихомониазом
Опубликовано в журнале:
«ЗДОРОВЬЕ МУЖЧИНЫ», 2008, №1, с. 26-30
В.М. Kрасовский
Институт урологии АМН Украины (Kиев)
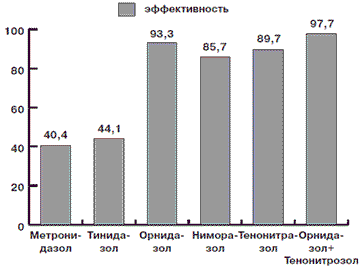
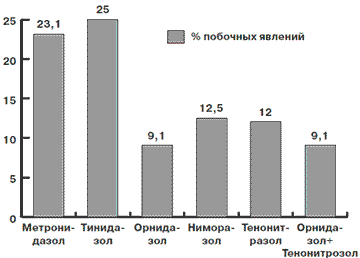
Изучена сравнительная эффективность использования препаратов Метронидазола, Тинидазола, Ниморазола, Тенонитрозола, Орнидазола в лечении 126 больных урогенитальным трихомониазом. Эффективность Метронидазола составила 40,4%, Тинидазола – 44,1%, Ниморазола – 85,7%, Тенонитрозола – 89,7%, Орнидазола – 93,3%, Орнидазола + Тенонитрозола – 97,7%. Препараты отличаются различной переносимостью и количеством побочных эффектов: Метронидазол – 23,3%, Тинидазол – 25%, Нимора-зол – 12,5%, Тенонитрозол – 12%, Орнидазол – 9,1%, Орнидазол + Тенонитрозол – 9,1%. Лучшие результаты получены в группах пациентов, которые получали: Орнидазол (93,3%), Тенонитрозол (89,7%), а также комбинация их последовательного применения Орнидазол + Тенонитрозол (97,7%). Результаты исследования можно использовать в клинической практике.
Kлючевые слова: хронический урогенитальный трихомониаз, лечение, Метронидазол, Тинидазол, Ниморазол, Тенонитрозол, Орнидазол.
Research of comparative efficiency of application of metronidazolum, tinidazolum, nimorazolum, tenonitrazolum, ornidazolum in treatment of patients with chronic urogenital trichmoniasis. V.M. Krasovsky
Keywords: chronic urogenital trichmoniasis, treatment, Metronidazolum, Tinidazolum, Nimorazolum, Tenonitrazolum, Ornidazolum.
В последние десятилетия трихомониаз получил широкое распространение. Чаще всего это заболевание диагностируют у мужчин и женщин молодого возраста – от 16 до 35 лет, из которых большой процент больных составляют лица с другими венерическими заболеваниями и те, кто часто меняют половых партнеров [1, 34].
Заражение трихомониазом происходит в основном половым путем, бытовым путем (плавая в бассейне или реке, в душе, в сауне) заразиться практически невозможно. Однако в сперме, моче и воде возбудитель остается жизнеспособным в течение 24 ч. У больных или у тех, кто перенес эту инфекцию, вырабатываются сывороточные и секреторные антитела, которые указывают на возбудителя, но иммунитет в отношении трихомонадной инфекции не развивается [1–5, 8, 11].
К главным особенностям заболевания следует отнести то, что возбудитель очень легко передается человеку, имевшему половую связь с инфицированным; наличие на поверхности микроорганизмов гиалуронидазы, каталазы, амилазы; способность повторять рельеф эпителиальной клетки и проникать в клетку хозяина; способность защититься от разрушительного действия организма с помощью фиксации на своей поверхности антитрипсина; наличие прямой зависимости вирулентности урогенитальных трихомонад от их гемолитической активности; способность прикрепляться к лейкоцитам, эритроцитам, эпителиальным клеткам за счет гликопротеида.
Выделяют несколько форм трихомониаза: свежая острая, подострая, торпидная; хроническая; трихомонадоносительство. Хроническая форма заболевания характеризуется малосимптомным течением, когда с момента заражения прошло более 2 мес. Периодические обострения могут быть спровоцированы снижением сопротивляемости организма, чрезмерным употреблением алкоголя, изменением рН содержимого мочеиспускательного канала. Трихомонадоносительство – форма заболевания, при которой отсутствуют какие-либо симптомы [2, 4, 5–10, 13].
Трихомониаз – многоочаговое заболевание. По данным Всемирной организации здравоохранения (1995), только у 10,5% больных трихомониаз протекает как моноинфекция, в 89,5% случаев выявляются смешанные трихомонадные инфекции в различных комбинациях: с микоплазмами – 47,3%; с гонококками – 29,1%; с гарднереллой – 31,4%; с уреаплазмой – 20,9%; с хламидиями – 20%; с грибами – 15%.
Диагностика трихомониаза осуществляется на основании клинических признаков и результатов лабораторных исследований. Для получения более точного результата используют сразу несколько методов, а материал для изучения берут из различных очагов воспаления. Применяют следующие лабораторные методы: латекс-агглютинация (используют для выявления трихомонадоносительства); культуральные (используют для диагностики атипичных форм); иммунологические; микроскопия нативного препарата (позволяет по грушевидной или овальной форме, а также характерным движениям микроорганизма определить наличие трихомонады); микроскопия окрашенного препарата (дает возможность проводить исследования, когда материал взят достаточно давно); люминесцентная микроскопия (основан на свечении микроорганизма в ультрафиолетовых лучах). Самый точный и современный метод – ДНK (ПЦР)-диагностика. Для ее проведения из биологического материала извлекают генетически уникальный кусочек ДНK микроорганизма. Все возможные ошибки данного метода составляют 5%. Этот метод отличается не только точностью, но и скоростью выполнения (1–2 дня) [2, 3, 5, 8–10, 12].
Лечение трихомониаза назначают обязательно после осмотра и лабораторного обследования с учетом количества очагов инфекции, тяжести заболевания и индивидуальных особенностей пациента. Кроме того, лечение трихомониаза по требованиям ВОЗ проводят всем половым партнерам, если у одного из них обнаружена инфекция (трихомонада). Особенностью заболевания является наличие множества очагов инфекции. Учитывая этот факт, больным назначают комплексную терапию, включающую: прротивопротозойные препараты; антибактериальные препараты; местное лечение; этиотропные методы; витамины; биостимуляторы; иммунокоррегирующие методы; симптоматическое лечение; гепатопротекторы; противогрибковые препараты. На фоне лечения половая жизнь и прием алкоголя не рекомендуются [2, 6–10,12, 13]. Выбор тактики лечения следует осуществлять индивидуально, с учетом клинико-анамнестических данных.
Лечение острой формы: этиотропная терапия; антибактериальные препараты по индивидуальным показаниям; ферменты, улучшающие пищеварение; витаминотерапия; противотрихомонадные препараты для местного применения в очагах воспаления. По окончании этиотропной терапии рекомендуется провести курс антиоксидантной терапии (перорально и местно) в сочетании с гепатопротекторными средствами.
Лечение хронической формы:
Первое контрольное обследование у мужчин проводят на 7–10-й день после окончания лечения трихомониаза: пальпаторное обследование предстательной железы и семенных пузырьков, микроскопическое исследование их секрета. Через 1 нед назначают провокацию. Если после провокации трихомонадная инфекция не обнаружена, то на последнее контрольное обследование пациент приходит через 1 мес.
Kритерии излеченности
Различают этиологическое и клиническое выздоровление от трихомониаза. Этиологическое выздоровление: при контрольных обследованиях после курса лечения трихомонады не обнаружены в течение 1–2 мес. у мужчин. Для контрольных обследований применяют культуральные и бактериоскопические лабораторные методы. Kлиническое выздоровление: исчезновение симптомов болезни. Нередко у мужчин после наступления этиологического выздоровления симптомы трихомониаза сохраняются. Посттрихомонадные воспалительные процессы бывают у пациентов с осложненными или хроническими формами болезни [9–13].
Этиотропную терапию трихомониаза проводят несколькими препаратами: это метронидазол, тинидазол, ниморазол, тенонитрозол, орнидазол, секнидазол, флюнидазол, карнидазол. Первых пять препаратов зарегистрированы и их применяют в Украине.
Лекарственная резистентность, ее механизмы и клиническое значение
В последние годы у микроорганизмов все чаще вырабатывается лекарственная резистентность к различными препаратам в связи с неконтролируемым, недостаточно интенсивным или длительным лечением, самолечением. Частота развития резистентности и уровень устойчивости существенно различаются в зависимости от вида микроорганизма, химического состава препарата, эффективности применяемых доз и схем лечения.
Развитие устойчивости связано в первую очередь со снижением активности нитроредуктаз микробной клетки и соответственно со снижением внутриклеточной биотрансформации препаратов. В результате уменьшается образование комплексов с ДНK, снижаются процессы образования свободных радикалов и концентрация цитотоксических продуктов метаболизма. Развитие устойчивости может быть обусловлено также нарушением транспортных систем клетки (снижение проницаемости клеточной стенки у анаэробов и микроаэрофилов и клеточной оболочки у простейших), включая феномен выброса.
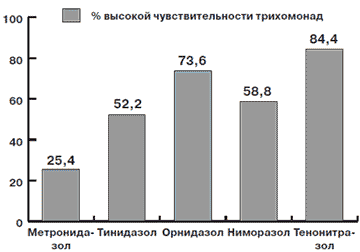
Kроме того, главной проблемой в лечении трихомониаза сегодня выступает всевозрастающая резистентность трихомонады к антипротозойным препаратам. Так, согласно исследованиям, проведенным авторами в 1999 г., всего 35% штаммов трихомонад чувствительны к метронидазолу [4]. Согласно другим исследованиям, всего 55% трихомонад чувствительны к тинидазолу [5]. Соответственно изучение изменяющейся чувствительности трихомонад к современным антипротозойным препаратам является актуальной проблемой лечения трихомониаза и микст-инфекций половых путей.
В связи с этим была сделана попытка провести исследование сравнительной эффективности различных противотрихомонадных препаратов.
МАТЕРИАЛЫ И МЕТОДЫ
В отделении сексопатологии и андрологии Института урологии АМН Украины изучали клиническую эффективность различных противотрихомонадных препаратов: Метронидазола, Тинидазола, Ниморазола, Тенонитрозола, Орнидазола у больных хроническим урогенитальным трихомониазом. Кроме того, проводили ретроспективный анализ чувствительности влагалищной трихомонады к различным противопротозойным препаратам и оценивали их эффективность и безопасность.
Под наблюдением находились 370 пациентов с хроническим урогенитальным трихомониазом в возрасте от 21 до 48 лет и длительностью заболевания от 3 мес. до 8 лет. Диагноз урогенитального трихомониаза устанавливали на основании общепринятых принципов с выявлением трихомонад, что подтверждено микроскопией окрашенных мазков, исследованием нативного препарата, культуральным методом, а также методом ПЦР.
Все больные были разделены на группы:
1-я группа (52 пациента) получала в качестве противотрихомонадного препарата Метронидазол в стандартной дозе на протяжении 10 дней.
2-я группа (43 пациента) – Тинидазол по 0,5 г 4 раза в день с интервалом 15 мин 2 дня.
3-я группа (49 мужчин) – Орнидазол по 0,5 г 2 раза в день на протяжении 10 дней.
4-я группа (56 мужчин) – Ниморазол по 0,5 г 2 раза в день на протяжении 6 дней.
5-я группа (126 мужчин) – Тенонитрозол по 0,25 г 2 раза в день на протяжении 8 дней.
6-я группа (44 мужчин) – Орнидазол по 0,5 г 2 раза в день на протяжении 10 дней и Тенонитрозол по 0,25 г 2 раза в день на протяжении 8 дней.
С целью коррекции иммунного статуса назначали индуктор интерферона растительного происхождения кагоцел; как гепатопротектор использовали препарат легалон – 140 мг в день стандартных доз на курс лечения. Для получения антибактериального эффекта (ввиду наличия TANK-функции у трихомонады) назначали препарат группы макролидов кларитромицин в дозе по 500 мг 2 раза в сутки на протяжении 10 дней; пациенты также получали симптоматическое и физиотерапевтическое лечение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Результаты комплексного курсового лечения пациентов в номинации «клиническое выздоровление» через 30 дней после окончания лечения приведено в табл. 1.
Таблица 1. Эффективность этиотропной терапии урогенитального трихомониаза различными препаратами
| Клиническая группа | Препарат | Количество больных | Клиническое выздоровление (абс. число) | Клиническое выздоровление, % |
| 1-я | Метронидазол | 52 | 21 | 40,4 |
| 2-я | Тинидазол | 43 | 19 | 44,1 |
| 3-я | Орнидазол | 49 | 45 | 93,3 |
| 4-я | Ниморазол | 56 | 48 | 85,7 |
| 5-я | Тенонитрозол | 126 | 113 | 89,7 |
| 6-я | Орнидазол + Тенонитрозол | 44 | 43 | 97,7 |
Результаты микроскопии секрета предстательной железы и молекулярно-генетического исследования соскоба слизистой оболочки мочеиспускательного канала мужчин в динамике приведено в табл. 3.
Таблица 3. Результаты микроскопии секрета предстательной железы при этиотропной терапии урогенитального трихомониаза различными препаратами
| Клиническая группа | Препарат | Количество больных | Микроскопия секрета ПЖ | ПЦР |
| 1-я | Метронидазол | 52 | 18 (34,6%) | 21 (40,4%) |
| 2-я | Тинидазол | 43 | 16 (37,2%) | 19 (44,1%) |
| 3-я | Орнидазол | 49 | 44 (89,8) | 45 (93,3%) |
| 4-я | Ниморазол | 56 | 44 (78,5%) | 48 (85,7%) |
| 5-я | Тенонитрозол | 126 | 121 (88,0%) | 113 (89,7%) |
| 6-я | Орнидазол + Тенонитрозол | 44 | 43 (97,7%) | 43 (97,7%) |
Kак видно из приведенных данных, лучшие результаты получены при использовании метода ПЦР в группах пациентов, которые получали: Орнидазол (93,3%), Тенонитрозол (89,7%), а также их комбинацию последовательного применения Орнидазол + Тенонитрозол (97,7%). Метод микроскопии показал несколько худшие результаты по всем группам пациентов, что обусловлено субъективностью самого метода и свойством мимикрии трихомонады. Но эффективность лечения в тех же группах была выше.
Рис 1. Процент высокой чувствительности трихомонады к различным препаратам
Кроме того, нами была оценена эффективность лечения различными препаратами больных, основываясь на полной эрадикации возбудителя, на что указывает молекулярно-генетический метод. Данные приведены на рис. 2.
Рис. 2. Эффективность терапии трихомониаза различными препаратами
При определении количества побочных явлений при использовании различных противопротозойных препаратов выявлены результаты, которые приведены на рис. 3.
Рис. 3. Количество побочных явлений при использовании различных противопротозойных препаратов
ВЫВОДЫ
Вагиниты, вызванные условно-патогенной микрофлорой: рекомендации для практикующих врачей
Сведения об авторе:
Пустотина Ольга Анатольевна, доктор медицинских наук, профессор кафедры акушерства, гинекологии и репродуктивной медицины ФПК МР РУДН Адрес: 117198 Москва, ул. Миклухо-Маклая д. 6, телефон 8 (495) 787-38-27, email: rudn@rudn.ru Pustotina Olga Anatolievna, Doctor of Medicine, Professor of The department of Obstetrics, Gynecology and Reproductive Health, Peoples’ Friendship University of Russia. Address: 117198 Moscow, Mikluho-Maklaya str, 6. Phone 8(495)7873827
Нормальная микрофлора женских половых органов
Таким образом, во влагалище здоровых женщин репродуктивного возраста общая численность бактерий составляет 105-106 КОЕ/мл выделений, 95% которых представлены лактобактериями и только 5% формируется представителями других видов аэробных и анаэробных УПМ.
Вагиниты, вызванные УПМ
Вагиниты бывают воспалительного и невоспалительного характера. Воспалительные вагиниты в зависимости от вида возбудителя разделяют на неспецифические и специфические. К специфическим относятся трихомонадный, хламидийный, гонококковый и грибковый вагинит (вагинальный кандидоз), при обнаружении любых других УПМ вагинит является неспецифическим. Невоспалительный вагинит называется бактериальным вагинозом. Бактериальный ваги- ноз, неспецифический вагинит и вагинальный кандидоз объединяют вагиниты, вызванные УПМ.
Бактериальный вагиноз не относится к инфекциям, передаваемым половым путем (ИППП), но связан с сексуальной активностью женщины и может вызывать симптомы уретрита у мужчин. Происходящие во влагалищном биотопе изменения облегчают восходящее инфицирование ИППП: гонококками, хламидиями, трихо- монадами, ВИЧ-инфекцией и др. Кроме того, накапливаясь в большом количестве, УПМ проникают в полость матки, вызывая хроническую воспалительную реакцию, приводя к бесплодию, невынашиванию беременности и снижению эффективности программ ЭКО [7, 8].
Вагинальный кандидоз-это воспаление слизистой оболочки влагалища, вызванное дрожжевыми грибами рода СапсНс1а, которое встречается у 5-10% женщин репродуктивного периода. Развитие кандидоза в основном расценивают как вторичную эндогенную инфекцию, резервуаром которой является желудочно-кишечный тракт. Основными причинами, способствующими проникновению грибов из аногенитальной области во влагалище и их интенсивному размножению, является прием антибиотиков, глюкокортикоидов, потребление пищи с большим количеством углеводов. Предрасполагающими к заболеванию факторами служат ожирение, сахарный диабет и нарушение правил личной гигиены 11.
Факторы риска вагинитов, вызванных УПМ
Устойчивость экосистемы влагалища определяется факторами эндогенного и экзогенного происхождения. К развитию дисбиотических процессов в вагинальном микроценозе наиболее часто приводят: стресс, лечение антибиотиками, гормональная терапия, эндокринные и аллергические заболевания, снижение иммунной защиты организма, хронические запоры, инфекция мочевых путей. Уменьшение доли лактобацилл и повышение рН в содержимом влагалища происходит при повреждениях эпителиального покрова в результате полового акта, трещин, расчесов, при чрезмерной гигиене наружных половых органов. Нередко женщины при появлении неприятного запаха из половых путей прибегают к спринцеванию. Спринцевание не имеет ни гигиенического, ни профилактического, ни лечебного эффекта, а усугубляет дис- биоз и является фактором риска воспалительных заболеваний органов малого таза. Нарушение экосистемы влагалища может возникать после полового акта вследствие действия спермы с высоким уровнем рН, при частой смене половых партнеров, во время аногенитальных контактов, при использовании некоторых спермицидов. Длительное маточное кровотечение, инородные тела во влагалище (тампоны, пессарии, швы при истмико-цервикальной недостаточности) нередко также сопровождаются патологическими выделениями из половых путей [4, 6, 7, 9].
Клиника и диагностика вагинитов, вызванных УПМ
В основе вагинитов, вызванных УПМ, лежит уменьшение колоний лактобактерий, в результате которого изменяется рН вагинальной среды с кислой на щелочную и создаются условия для разрастания УПМ и их адгезии на освобождающийся эпителий слизистой оболочки влагалища.
Все происходящие изменения вагинального биотопа объединяются диагностическими критериями Амселя: появление специфических белей из половых путей, увеличение рН вагинального отделяемого, «рыбный» запах и наличие «ключевых клеток», представляющих собой эпителиальные клетки, порытые сплошным слоем различных микроорганизмов. По последним данным, даже наличие двух критериев из четырех позволяет установить нарушение вагинального микробиоценоза [5].
Кроме того, возбудители ИППП, такие как хламидии, трихомонады, гонококк и Мусор1а5та депйаПит, также могут колонизировать генитальный тракт, не нарушая нормальный рост лактобактерий и не изменяя рН влагалищного содержимого, в следствие чего до 90% случаев инфицирования ИППП протекают бессимптомно. Поэтому международные и отечественные эксперты 14 рекомендуют дополнительно к микроскопическому исследованию, обладающему низкими диагностическими возможностями в отношении облигатных патогенов, использовать метод полимеразной цепной реакции (ПЦР) для выявления антигенов хламидий, трихо- монад, гонококка и Мусор1а5та депИаИит в отделяемом половых путей.
Таким образом, окончательный диагноз вагинитов, вызванных УПМ, устанавливается при наличии у женщины жалоб на патологические вагинальных выделения и данных микроскопического исследования, и только после исключения ИППП методом ПЦР.
Лечение вагинитов, вызванных УПМ
Первый этап: Противомикробная терапия.
Препаратами выбора для лечения бактериального вагиноза являются производные нитроимидазола и линкозамиды, которые наиболее активно подавляют размножение анаэробной микрофлоры:
Исследования показали, что ни у одной из схем нет преимуществ в эффективности терапии [7], однако при местном использовании значительно реже возникают побочные эффекты [16].
Для лечения неспецифического вагинита рекомендуется использовать клин- дамицин (300 мг 2 р/сут 7 дней, вагинальный крем 2% 5г 7 дней, свечи 100 мг вагинально 3 дня). В сравнении с производными нитроимидазола (метронидазол, тинидазол, орнидазол), он имеет более широкий спектр действия, включающий не только анаэробные, но и аэробные грамположительные и грамотрицательные бактерии [3, 12, 13, 17, 18].
В последние годы опубликованы результаты крупных рандомизированных контролируемых исследований, показавших высокую эффективность лечения нарушений вагинального микробиоценоза еще двумя антибиотиками широкого спектра действия: рифаксимина (250 мг вагинально 5 сут) [19] и нифуратела (250 мг вагинально 10 сут) [20].
Следует отметить, что все выше представленные антибактериальные средства, обладая выраженной подавляющей активностью в отношении УПМ, не влияют на жизнедеятельность полезных молочно-кислых бактерий [15, 19, 20].
Терапия вагинального кандидоза проводится антимикотиками, среди которых препаратами первой линии являются азолы для интравагинального применения (имидазолы):
и азолы для приема внутрь (триазолы):
При остром неосложненном вагинальном кандидозе, вызванном СапсМс1а а1Ысап5, все препараты местного и системного действия одинаково эффективны.
В случаях рецидивирования процесса длительность и количество курсов увеличивается, при этом необходимо идентифицировать вид кандидозной инфекции и исключить возможные факторы риска [10,12-14].
Антисептики:
В настоящее время получено множество доказательств эффективности терапии вагинитов, вызванных УПМ, различными антисептическими средствами, такими как:
Все антисептики обладают широким неспецифическим спектром действия и подавляют рост аэробных и анаэробных микроорганизмов, а также грибов рода СапсМс1а, при этом не влияя на жизнедеятельность колонии лактобактерий [15].
Наибольшая доказательная база (уровень доказательности 1А) продемонстрирована для деквалиния хлорида (флуомизина). В крупномасштабных многоцентровых рандомизированных зарубежных [21 ] и отечественных исследованиях (БИОС-1/М) [18, 22, 24] с участием 321 и 640 пациенток, соответственно, деквалиния хлорид показал сопоставимую эффективность с действием клиндамицина при лечении вагинитов, вызванный УПМ, при значительно лучшей переносимости и меньшей частоте развития кандидоза. Кроме того, вагинальные таблетки деквалиния хлорида обладают хорошей всасываемостью и меньшей текучестью в сравнении с хлоргексидином, поэтому назначаются один раз в сутки, не вызывая аллергических и других побочных эффектов, характерных для повидон-йода, при этом более эффективно уменьшая количество «ключевых клеток» и ПЯЛ в вагинальном мазке [18, 22].
Второй этап: восстановление микробиоценоза
Одной из причин хронизации процесса являются бактериальные пленки, формирующие невосприимчивость микроорганизмов к действию антибактериальных и антисептических средств [23]. В результате уровень излеченности через 3 мес составляет 60-70% и еще ниже через 6 мес [6]. Значительное повышение эффективности терапии вагинитов происходит после проведения второго этапа, направленного на восстановление нормального микробиоценоза [22, 23, 25].
Наилучшие результаты продемонстрировало применение пробиотиков, содержащих живые лактобактерии. Они не только подавляют рост УПМ, ассоциированных с бактериальным вагинозом и неспецифическим вагинитом, за счет образования молочной кислоты, перекиси водорода и бактериоцинов, но и способны разрушать образованные ими биопленки, а также модулируют иммунный ответ и способствуют размножению колоний эндогенных лактобактерий [4, 12, 19, 24, 26, 27].
В качестве дополнительного фактора, улучшающего состояние вагинального микробиоценоза после антимикробной терапии, является применение вагинальных таблеток аскорбиновой кислоты. [28]. В то же время, применение исключительно пробиотиков и/или закисления вагинальной среды без предшествующей антимикробной терапии для лечения вагинитов, вызванных УПМ, недостаточно [7].
Лечение вагинитов, вызванных УПМ, у беременных
Нарушение вагинального микробиоценоза у беременных достоверно сопряжено с повышенным риском преждевременных родов, восходящего инфицирования плода и послеродовых гнойно-септических осложнений [1,8, 29-31 ].
Согласно зарубежным рекомендациям [12, 13] терапия бактериального вагино- за и неспецифического вагинита у беременных женщин не отличается от таковой у небеременных. Препаратом первой линии считается метронидазол для системного и местного применения. При осложненном течении беременности и высоком риске преждевременных родов более эффективным считается назначение клиндамицина, обладающего более широким спектром активности 33. При этом терапию нарушений биоценоза влагалища необходимо проводить с самых ранних сроков беременности [36].
В отечественных рекомендациях [14] антибиотики из группы нитроимидазола и линкозамидов противопоказаны в первом триместре, их применение возможно только местно после 12 нед беременности. Поэтому препаратами выбора для беременных являются вагинальные антисептики широкого спектра действия. Среди антисептических средств только у деквалиния хлорида безопасность применения на любом сроке беременности и в период грудного вскармливания подтверждена в масштабных многоцентровых исследованиях [18, 21, 22, 24]. Беременным с вагинальным кандидозом показано местное применение азолов (клотримазол, миконазол, терканозол и др.) 12. В случаях неэффективности терапии предусмотрено интравагинальное назначение полиенов (натамицин, нистатин) 14. В дальнейшем для профилактики рецидивов вагинальных выделений беременным назначаются пробиотики и средства, подкисляющие вагинальную среду [28, 36].
В заключение хочется отметить, что вагинальный микробиоценоз напрямую связан с состоянием здоровья женщины. Любые нарушения гомеостаза могут сопровождаться патологическими выделениями из половых путей, которые нередко бывают кратковременными, и после нормализации общего состояния самостоятельно проходят. В случаях рецидивирования процесса основной задачей врача является не поиск и идентификация возможных возбудителей, которых при вагинитах, вызванных УПМ, как правило множество, а выяснение причин, приведших к длительному течению заболевания. Для постановки правильного диагноза достаточно простой микроскопии вагинального мазка и метода ПЦР для исключения строгих патогенов. При рецидивирующих патологических вагинальных выделениях необходим также тщательный сбор анамнеза для выявления всех возможных факторов риска, только после устранения которых достигается полноценное восстановление вагинального микробиоценоза.
Список использованной литературы
1. Гуртовой Б.Л., Кулаков В.И., Воропаева С.Д. Применение антибиотиков в акушерстве и гинекологии. – М.: Триада-Х, 2004. – 176с.
2. Sweet RL, Gibbs RS. Infectious diseases of the female genital tract. – 5th ed. Lippincott Williams Wilkins, 2009. 469p.
4. Радзинский В.Е. Бактериальный вагиноз. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Издат журнала StatusPraesens, 2014. – С.249-280.
5. Mittal V, Jain A, Pradeep Y. Development of modified diagnostic criteria for bacterial vaginosis at peripheral health centres in developing countries/ J Infect Dev Ctries. 2012; 6(5): 373-377.
6. Verstraelen H, Verhelst R. Bacterial vaginosis: an update on diagnosis and treatment/ Expert Rev Anti Infect Ther. 2009;7:1109–1124.
7. Donders GG, Zodzika J, Rezeberga D. Treatment of bacterial vaginosis: what we have and what we miss/ Expert Opin Pharmacother. 2014;15(5): 645-657.
8. Leitich H, Bodner-Adler B, Brunbauer M. et al. Bacterial vaginosis as a risk factor for preterm delivery: a meta-analysis/ Am J Obstet Gynecol. 2003;189: 139–147.
9. Filler SG. Insights from human studies into the host defense against candidiasis/ Cytokine. 2012; 58(1): 129-132.
10. Байрамова Г.Р. Рецидивирующий вульвовагинальный кандидоз: автореф. дис. докт.мед.наук.– М., 2013.
11. Роговская С.И., Липова Е.В., Яковлева А.Б. Вульвовагинальные микозы. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Изд-во журнала StatusPraesens, 2014. – С.281-308.
12. CDC. Sexually Transmitted Diseases Treatment Guidelines 2010. http://www.cdc.gov/std/treatment/2010/pid.htm
13. Sherrard J, Donders G, White D. European (IUSTI/WHO) Guideline on the management of vaginal discharge in women reproductive age. 2011.
14. Клинические рекомендации РОАГ. Акушерство и гинекология. – 4-е изд./ под ред. В.Н. Серова, Г.Т. Сухих. – М.: ГЭОТАР-Медиа, 2014. – 1024с.
15. Профилактика, диагностика и лечение инфекций, передаваемых половым путем: рук-во для дерматовенерологов, акушеров-гинекологов, урологов и семейных врачей. – М.:Институт здоровья семьи, 2008.
16. Mikamo H, Kawazoe K, Izumi K, et al. Comparative study on vaginal or oral treatment of bacterial vaginosis / Chemotherapy. 1997; 43:60-68.
17. Практическое руководство по антиинфекционной химиотерапии// Под ред. Л.С. Страчунского, Ю.А. Белоусова, С.Н. Козлова. – М., 2007. – 462с.
18. Подзолкова Н.М., Никитина Т.И. Сравнительная оценка различных схем лечения больных с бактериальным вагинозом и неспецифическим вульвовагинитом // Рос вестник акуш гинекол, 2012.- №4. – С.75-81.
19. Donders GG, Guaschino S, Peters K, et al. A multicenter, double-blind, randomized, placebocontroled study of rifaximin for the treatment of bacterial vaginosis/ Int J Gynaecol Obstet. 2013; 120:131-136.
21. Weissenbacher ER, Donders G, Unzeitig V. et al. Fluomizin Study Group. A comparison of dequalinium chloride vaginal tablets (Fluomizin®) and clindamycin vaginal cream in the treatment of bacterial vaginosis: a single-blind, randomized clinical trial of efficacy and safety. Gynecol Obstet Invest.
2012; 73: 8–15.
23. Swidsinski A, Verstraelen H, Loening-Baucke V. et al. Presence of a polymicrobial endometrial biofilm in patients with bacterial vaginosis/ PLoS One. 2013;8:e53997.
25. McMillan A, et al. Disruption of urogenital biofilms by lactobacilli / Colloids Surf B Biointerfase,2011; 86(1): 58-64.
26. Larsson PG, Stray-Pedersen B, Ryttig KR, Larsen S. Human lactobacilli as supplementation of clindamycin to patients with bacterial vaginosis reduce the recurrence rate; a 6-month, double-blind, randomized, placebo-controlled study./ BMC Women Health, 2008;15(8):3.
27. Ya W, Reifer C, Miller L E. Efficacy of vaginal probiotic capsules for recurrent bacterial vaginosis: a double blind, randomized, placebo-controlled study. Am J Obstet Gynecol. 2010; 203:1200–1208.
28. Zodzika J, Rezerberga D, Donders G. et al. Impact of vaginal ascorbic acid on abnormal vaginal microflora / Arch Gynecol Obstet 2013; 288: 1039-1044.
29. Bothuyne-Queste E, et al. Is the bacterial vaginosis risk factor of prematurity? Study of a cohort of 1336 patients in the hospital of Arras/ J Gynecol Obstet Biol Reprod. 2012; 41(3): 262-270.
30. Pustotina OA, Bubnova NI, Yezhova LS. Pathogenesis of hydramnios and oligohydramnios in placental infection and neonatal prognosis /J mat-fetal&neonat med. 2008; 21(1): 267-271.
31. Pustotina OA. Urogenital infection in pregnant women: clinical signs and outcome /J Perinat Med, 2013; 41:135.
32. Simcox R, Sin WT, Seed PT, et al. Prophylactic antibiotics for the prevention of preterm birth in women at rick: a meta-analysis/ Aust N-Z J Obstet Gynaecol. 2007; 47: 368-377.
33. McDonald HM, Brocklehurst P, Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy/Cochr Database Syst Rev. 2007. N1.P.CD000262.
34. Lamont RF, Duncan SLB, Mandal D, et al. Intravaginal clindamycin to reduce preterm birth in women with abnormal genital tract flora/ Obstet Gynecol. 2003;101:516–522.