Миопатия врожденная что это
Врождённые мышечные дистрофии и структурные миопатии
Врождённые (конгенитальные) миопатии — группа генетически обусловленных миопатий, характеризующихся ранним началом (обычно с рождения до 1 года), характерным симптомокомплексом (синдромом «вялого ребёнка» ) и непрогрессирующим или медленно прогрессирующим течением. Среди конгенитальных миопатий выделяют конгенитальные мышечные дистрофии и конгенитальные миопатии (структурные миопатии).
КЛИНИЧЕСКАЯ КАРТИНА
Большинство конгенитальных миопатий и дистрофий проявляется синдромом «вялого ребёнка». Клинические проявления синдрома «вялого ребёнка» сводятся к выраженной мышечной гипотонии, слабому сопротивлению мышц при пассивных движениях, недержанию головы, задержке моторного развития, гипермобильности суставов. Синдром «вялого ребёнка» также наблюдают при спинальных мышечных атрофиях и других врождённых заболеваниях ЦНС, болезнях обмена (гликогенозы, аминоацидурии) и др. Приблизительно 80% случаев синдрома «вялого ребёнка» обусловлены первичным поражением ЦНС. Основной метод диагностики врождённых миопатий — морфологическое исследование мышц; ЭМГ лишь подтверждает первично-мышечный характер поражения на начальном этапе дифференциальной диагностики. Наряду с синдромом «вялого ребёнка» отмечаютслабость лицевой мускулатуры, мышц туловища и дыхательной мускулатуры. У большинства развиваются Koнтpaктypы тазобедренных, коленных и локтевых суставов, мышц-разгибателей шеи, сколиоз, позже может присоединиться наружная офтальмоплегия. Несмотря на задержку моторного развития, большинство детей способны самостоятельно сидеть, некоторые могут самостоятельно ходить (при частичном дефиците мерозина). При ЭМГ выявляют первично-мышечный тип изменений, при этом спонтанная активность мышечных волокон либо отсутствует, либо незначительна.
СИМПТОМЫ
ЛЕЧЕНИЕ
Лечение должно производиться исключительно врачом-неврологом. Самолечение недопустимо. Специфической терапии не существует, цель лечения — коррекция ортопедических нарушений (дисплазия тазобедренных суставов, сколиоз), профилактика контрактур, поддержание мышечной силы, терапия кардиомиопатии и симптоматической эпилепсии.
Врожденные миопатии
Врожденные миопатии — это широкое понятие нервных мышечных расстройств, группа редких первичных дефектов мышц, которые передаются по наследству, вызывают гипотонию при рождении или в период новорожденности. Заболевания, относящиеся к группе врожденных миопатий, имеют сложную клиническую картину и схожие симптомы, что значительно усложняет их диагностирование и лечение.
Проявляется как диффузная мышечная слабость и снижение мышечного тонуса, степень выраженности которых напрямую зависит от разновидности миопатии и уровня ее сложности. В тяжелых случаях может привести к летальному исходу от дыхательной недостаточности.
Врождённая миопатия — заболевание генетически обусловленное. Различные виды миопатии могут находиться в разных локусах хромосом, поэтому могут передаваться по наследству рецессивно, доминантно или совместно с Х-хромосомой. Генетическая патология нарушает синтез белка, который входит в состав мышечной ткани, что приводит к нарушению строения мышечных волокон. В следствие этого, мышцы утрачивают возможность нормально сокращаться, наблюдается мышечная слабость.
Проявляется врожденная миопатия обычно в раннем детском возрасте (очень редко проявляется у взрослых) и сохраняет свою симптоматику на протяжении всей жизни больного. Чаще всегоданное заболевание слабо прогрессирует или не прогрессирует совсем.
Патогенез миопатии до конца не изучен и причины появления не выяснены. Существует гипотеза «дефекта мембран» мышечных клеток и цитоплазматических органелл, которую многие неврологи называют причиной зарождения заболевания.
Классификация врожденной миопатии
Биопсия мышц дает определенные биохимические и морфологические данные, на основании которых все заболевания врожденной миопатии можно условно разделить две большие группы.
Врожденные мышечные дистрофии
Первая группа — это врожденные мышечные дистрофии (нарушение функции и строения мышечных волокон в результате сбоя синтеза белков, которые входят в их состав). Четкой классификации врожденных мышечных дистрофий нет, но на основании гипотез патогенеза данной группы заболевания можно выделить две группы:
Мерозин-негативная группа заболеваний подразделяется на несколько типов:
Клиническая картина заболеваний мерозин-негативной группы очень схожа с симптоматикой классических врожденных миопатий, но отличительной особенностью является вовлечение в общую симптоматику различных структур головного мозга, что ведет к дальнейшей умственной отсталости, задержке развития. Заболевания мерозин-позитивной группы намного реже включают в себя поражение центральной нервной системы (приблизительно у 10% больных выявлено поражение мозга) и обычно не влечет за собой торможение интеллекта. Клиническая картина характеризуется деформацией позвоночника и нарушением черт строения лица.
Врожденные структурные миопатии
Вторая группа — врожденные структурные миопатии (нарушения целостности цитоскелета мышечных волокон и возникновение патологии в биоптате мышц). Эта группа заболеваний характеризуется нарушением синтеза белков, отвечающих за рост и другие функции формирования мышц в раннем развитии эмбриона.
К врожденным структурным миопатиям относят:
Клинические картины каждого из заболеваний данной группы похожи друг на друга и характеризуются мышечной гипотонией и гипертрофией, пониженной рефлективностью в сухожильях и повышением концентрации в крови креатинфосфокиназы. Наблюдается медленное прогрессирование.
Симптомы врожденной миопатии
Врожденная миопатия дебютирует чаще всего в первые месяцы жизни ребенка. Характеризуются данные заболевания наличием синдрома «вялого ребенка»: заметное снижение мышечного тонуса, слабость в мышцах, плохо развивается мускулатура и наблюдается обессиливание во время процесса сосания. С развитием ребенка мышечная слабость более заметно выражена — нехватка сил для того, чтобы стать на ножки или просто поднять свое тело, могут возникнуть трудности при ходьбе или сидении, наблюдается заметное отставание в физическом развитии по сравнению с другими детьми такого же возраста.
Слабость в мышцах может быть выражена сильно или незначительно. Чаще всего симптоматика сохраняется на весь период жизни больного и практически не прогрессирует или слабо развивается. В отдельных случаях, можно наблюдать невозможность самостоятельно передвигаться, поэтому больной вынужден использовать коляску, но навыки самообслуживания, приобретенные им, не утрачиваются.
Врожденные миопатии провоцируют не только слабость мышц конечностей и спины, слабеют и мышцы дыхательной мускулатуры, что является особенно опасным для детей грудного возраста. Если мышечная слабость дыхательных путей выражена в малой степени, то наблюдается развитие дыхательной недостаточности. Это, в свою очередь, провоцирует различные заболевания дыхательных путей (бронхиты, всевозможные виды пневмоний). Иногда дыхательная недостаточность приводит к летальному исходу еще в младенческом возрасте. Бывают случаи, когда с возрастом слабость мышц уменьшается или наоборот прогрессирует.
В отдельных случаях врожденная миопатия проявляется также в виде дисморфичных черт лица (удлиненная форма черепа, высокое небо) или патологиями развития скелета (сколиоз, косолапость, врожденный вывих бедра, кифоз).
Характеристика отдельных видов врожденной миопатии
Болезнь центрального стержня
Наследуется аутосомно-доминантным способом с неполной пенетрантностью (но встречаются и спорадические случаи наследственности). Данная форма врожденной миопатии характеризуется патологией проксимальных мышц конечностей, но больные способны приобрести некоторые двигательные навыки. В младенческом возрасте наблюдается задержка двигательного развития и гипотония, но диагностировать данное заболевание можно только в более позднем возрасте при изменениях скелета и выраженной мышечной слабости. При этом наблюдаются патологии скелета: деформация стоп, кифосколиоз, дислокация бедер, грудь сапожника.
Чаще всего, больные имеют хрупкую фигуру и невысокий рост. При диагностике заболевания проводят биоптат мышц, который показывает наличие множественных или единичных прерывистых зон, которые лишены ферментов окисления, в некоторых мышечных волокнах. Проведение других лабораторных анализов может показать норму. Пациенты с болезнью центрального стержня склонны к развитию злокачественной гипертермии.
Немалиновая миопатия
Второе название данного заболевания — врожденная непрогрессирующая нитеобразная миопатия. Наследственность в основном передается по аутосомно-доминантному типу, но встречается также рецессивный и спорадический. Возможен летальный исход вследствие дыхательной недостаточности в раннем младенческом возрасте. Наблюдается сильно выраженные патологии скелета. Развитие болезни может происходить в той или иной степени, а может не прогрессировать вовсе. В отдельных случаях больные вынуждены передвигаться с помощью сидячей каталки, в других — страдают от дыхательной недостаточности. При диагностировании проводится гистологическое исследование, которое выявляет в мышцах неподобные или палочкоподобныене малиновые тельца. ЭМГ обычно утверждает диагноз миопатии.
Миотубулярная миопатия
Данный тип врожденной миопатии наследуется по аутосомно-рецессивному типу. Миотубулярная миопатия характерна наличием центрально расположенных ядер в большинстве мышечных волокон. Это напоминает вид мышцы на миотубулярном внутриутробном развитии плода. В следствии этого заболевание и получило свое название.
Диагностика врожденной миопатии
Диагностика при врожденных миопатиях — сложный процесс, поскольку врачу необходимо дифференцировать и определить конкретный вид миопатии для назначения адекватного лечения и постановки правильного диагноза. Врач-невропатолог выявляет неврологические симптомы, проводит электрофизиологическое и биохимическое исследование, чтобы установить гетерозиготное носительство миопатического гена. Электромиографическое исследование с помощью накожных электродов показывает зачастую снижение вольтажа кривой ЭМГ. При биохимическом анализе крови в сыворотке наблюдается повышенная концентрация альдолазы и креатинкиназы.
Лечение врожденной миопатии
Лечение врожденный миопатий малоэффективное. Четкого лечения на данный момент нет. О том, можно ли лечить врожденную миопатию, ученые спорят до сих пор. Медицинские институты разных стран проводят исследования на генном уровне — с использованием стволовых клеток. Существует симптоматическое лечение, которое заключается в воздействии на обменные процессы в организме пациента, в частности, синтез белков, попытку нормализации функций вегетативной нервной системы. Чаще всего медикаментозное лечение включает в себя принятие анаболических гормонов (неробол, цераксон, ретаболил, сомазин), АТФ. Обязательно проводится витаминотерапия. Назначаются также антихолинэстеразные препараты.
Обязательным звеном процесса лечения врожденных миопатий является лечебная физкультура. Это могут быть занятия в воде или комплекс упражнений. ЛФК контролируется тренером или неврологом. В отдельных случаях действенной оказывается ортопедическая коррекция (например, ношение ортопедической обуви, корсетов или использование ортопедических матрасов, подушек, кресел).
Состояние и клиническую картину заболевания контролирует невропатолог, терапевт, педиатр, кардиолог и ортопед-травматолог.
Врожденная миопатия
Врожденные миопатии — группа редких наследственных заболеваний, при которых поражаются мышцы. Обычно признаки мышечной слабости появляются с рождения. С течением времени они, как правило, медленно прогрессируют. Врожденная миопатия отличается от других наследственных заболеваний, при которых поражаются мышцы, например, от болезни Помпе. 1
Болезнь Помпе — редкая генетическая патология, которая передается по аутосомно-рецессивному типу. Ее признаки могут впервые появиться в любом возрасте — как у новорожденных, так и у пожилых людей. Из-за наследственной мутации в организме развивается недостаточность фермента кислой альфа-глюкозидазы, или кислой мальтазы, которая расщепляет гликоген. 1
Нерасщепленный гликоген накапливается в мышцах, что приводит к их поражению. Классические симптомы болезни Помпе — выраженное снижение мышечного тонуса, постоянно усиливающаяся мышечная слабость, увеличение размеров сердца (при развитии заболевания у детей до 1 года), одышка. Болезнь постоянно прогрессирует, однако при своевременном лечении можно значительно улучшить состояние и прогноз жизни пациента. 1
Так же, как и болезнь Помпе, врожденные структурные миопатии связаны с генными мутациями. Какие виды миопатий встречаются чаще, как они проявляются и лечатся?
Классификация и симптомы
Выделяют несколько видов классических патологий. Самые распространенные формы 2 :
Симптомы патологий могут быть различными. Один из главных признаков – мышечная слабость, которая появляется с рождения. Тем не менее, известны случаи, когда слабость появляется во взрослом возрасте, хотя это происходит нечасто. 2
Слабость мышц может возникать внутриутробно, из-за чего плод недостаточно активен. Наибольшая гипотония мышц обычно отмечается в тазовом поясе и ногах. Мышцы рук и плечевого пояса страдают меньше. 2
При миопатии у детей могут выявляться скелетные аномалии — вывих бедра, полая стопа, кифосколиоз, контрактуры крупных суставов и другие. Иногда могут возникать мышечные боли во время или после физической нагрузки и даже в состоянии покоя. 2
Выраженность симптомов может быть очень незначительной, настолько, что иногда человек даже не подозревает, что болеет. Но некоторые патологии проявляются конкретными признаками. К примеру, при немалиновой миопатии развивается сколиоз, килевидная грудная клетка, а лицо приобретает удлиненную, продолговатую форму. 2
Особенности распространенных форм врожденной миопатии
Болезнь «центрального стержня» связана с генетическими нарушениями молекул, которые перераспределяют кальций в мышцах при сокращении. Это приводит к нарушениям в центральных зонах скелетно-мышечных волокон, внутри большинства из них образуются «стержни»-тяжи. Классические признаки заболевания – мышечная слабость, снижение тонуса мышц. 3
Многостержневые миопатии характеризуются наличием множественных участков мышечного волокна, имеющих сниженную окислительную активность. Болезнь обычно проявляется в младенческом возрасте с мышечной гипотонии и задержки формирования двигательных навыков на несколько месяцев. К примеру, ходить ребенок с многостержневой миопатией начинает на 4-6 месяцев позже, чем здоровый. 4
Центроядерная миопатия — заболевание, при котором в мышечных волокнах образуется множество центральных ядер. В зависимости от типа наследования может проявляться в младенческом, подростковом и взрослом возрасте. В первом случае прогноз наиболее неблагоприятен. 5
Немалиновая миопатия характеризуется наличием в цитоплазме мышечных волокон включений в форме нитей. Заболевание проявляется мышечной слабостью, снижением мышечного тонуса, задержкой в приобретении двигательных навыков у детей. 6
Диагностика
При появлении мышечной слабости важно обратиться к врачу, чтобы выяснить причину и диагностировать патологию. При подозрении на врожденную миопатию врач может назначать комплексное обследование, в которое входят:
Лечение
Существует только симптоматическое лечение заболевания. В первую очередь оно направлено на поддержание дыхания, поскольку эти расстройства считаются одними из самых тяжелых осложнений. Для коррекции дыхательных нарушений назначают лечебную физкультуру, массаж, другие лечебные процедуры. 2
Для коррекции контрактур, нарушений осанки рекомендуют занятия лечебной физкультурой, физиотерапевтическое лечение, иглорефлексотерапию. А вот лекарственных препаратов, способных эффективно облегчить течение этих патологий, не существует. 2 В отличие от болезни Помпе, для лечения которой доступна патогенетическая терапия. 1
Прогноз
Различные виды мышечных миопатий имеют разную степень тяжести: от выраженной, приводящей к инвалидизации, до минимальных проявлений. Прогноз зависит от вида патологии. Важный критерий прогноза — скорость нарастания мышечной слабости: чем медленнее она прогрессирует, тем лучше прогноз.
Врожденная миопатия
Общая информация
Краткое описание
— гипотония, слабость или артрогрипоз представлены с рождения;
— мышечная биопсия обнаруживает признаки миопатии (изменение размеров волокон, дегенерация волокон среднего размера, замещение мышечных волокон жировой тканью и коллагеном) и исключает денервацию;
— другие формы миопатии со специфическими клиническими признаками у новорожденных исключены.
Протокол «Врожденная миопатия»
Код по МКБ-10: G71.2
Врожденная мышечная дистрофия:
— со специфическими морфологическими поражениями мышечного волокна.
Диспропорция типов волокон
— немалиновая (болезнь немалинового тела).
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
1. Врожденные миопатии.
2. Болезнь центрального стержня.
3. Врожденная миопатия с диспропорцией типов волокон.
4. Миотубулярная (центронуклеарная) миопатия.
5. Острая миотубулярная миопатия.
6. Хроническая миотубулярная миопатия.
7. Немалиновая миопатия.
Диагностика
Диагностические критерии
Жалобы и анамнез: заболевание проявляется с рождения или в раннем детском возрасте; задержка в моторном развитии, гипотрофия, мышечная слабость, снижение тонуса и мышечной силы, нарушение походки.
Физикальные обследования
Лабораторные исследования: возможно повышение уровня КФК в сыворотке крови.
Инструментальные исследования:
1. Компьютерная томография головного мозга для исключения органического поражения.
Показания для консультаций специалистов:
Минимум обследования при направлении в стационар:
1. Общий анализ крови.
2. Общий анализ мочи.
3. Кал на яйца глист.
Основные диагностические мероприятия:
1. Общий анализ крови.
2. Общий анализ мочи.
10. Электромиография (ЭМГ).
14. Определение креатинкиназы в сыворотке крови.
Перечень дополнительных диагностических мероприятий:
1. Компьютерная томография головного мозга.
5. МРТ головного мозга.
7. R-графия грудной клетки.
8. УЗИ органов брюшной полости.
14. Мышечная биопсия.
Дифференциальный диагноз
Заболевания
Начало заболевания
Течение заболевания
С рождения или в раннем детском возрасте, проявляется снижением мышечной силы и гипотонией мышц.
Снижение амплитуды ЭМГ максимального напряжения, длительность потенциалов ДЕ уменьшена, увеличение числа полифазных потенциалов.
Доброкачественное течение, стационарное или медленно прогрессирующее. При некоторых формах двигательные функции с возрастом улучшаются.
ДЦП. Атонически-астатическая форма
С рождения, на первый план выступает выраженная мышечная гипотония.
При произвольном сокращении регистрируется интерференционная кривая со сниженной амплитудой; фибрилляции, фасцикуляции отсутствуют.
Не прогрессирует, по мере роста и развития ребенка происходит регресс некоторых симптомов.
Заболевание начинается на 1-ом году жизни или обнаруживается уже при рождении. Спонтанная двигательная активность резко ослаблена.
Дегенерация мотонейронов спинного мозга, проявляющаяся ритмом частокола, II тип. В тяжелых случаях полное биоэлектрическое молчание.
Неуклонно прогрессирующее заболевание, обусловленное уменьшением и дегенерацией клеток мотонейронов спинного мозга.
Лечение
Тактика лечения
Цель лечения: улучшение трофики мышц и проведение импульса по нервному волокну и через мионевральный синапс; улучшение двигательной активности, социальная адаптация, профилактика патологических поз и деформаций.
Немедикаментозное лечение:
— массаж общий, тонизирующий;
— занятия с логопедом, психологом.
Медикаментозное лечение:
1. Нейропротекторы: церебролизин, актовегин, пирацетам, пиритинол, гинкго-билоба.
2. Стимулирующая терапия: прозерин, дибазол, галантамин, оксазил, нейромидин.
3. Ангиопротекторы: винпоцетин, циннаризин.
5. Комплексы аминокислот: метионин, глицин.
6. Анаболические стероиды: неробол, ретаболил, оротат калия.
Профилактика осложнений:
— предупреждение контрактур, патологических поз;
— профилактика вирусных и бактериальных инфекций.
Дальнейшее ведение:
— регулярные занятия ЛФК;
— обучение родителей навыкам массажа, ЛФК;
— носить ортопедическую обувь.
Перечень основных медикаментов:
2. Актовегин ампулы по 80 мг, 2 мл
3. Нейромультивит (витамины В1, В6, В12), таблетки
4. Оротат калия, таблетки
5. Пирацетам, ампулы по 5 мл, 20%
6. Пиридоксин гидрохлорид, ампулы по 1 мл, 5%
7. Прозерин, ампулы 0,05%, 1 мл
8. Прозерин, таблетки 0,015
9. Тиамин хлорид ампулы, 1 мл, 5%
10. Фолиевая кислота, таблетки 0,001
11. Цианокобаламин, ампулы 200 и 500 мкг
Дополнительные медикаменты:
1. Винпоцетин, таблетки 5 мг
2. Галантамин, ампулы 0,25%, 1мл
3. Гинкго-Билоба, (танакан) таблетки 40 мг
4. Глицин, таблетки 0,1
5. Дибазол, таблетки 0,02
6. Колекальциферол 1 мл, 15 тыс. МЕ
7. Луцетам, таблетки 0,4
8. Магне В6, таблетки
9. Нандролона деканоат (ретаболил), ампулы 1 мл, 50 мг
10. Неуробекс, таблетки
11. Оксазил, таблетки 0,001
12. Пирацетам, таблетки 0,2
13. Пиритинол, суспензия или таблетки 0,1
14. Токоферолола ацетат (витамин Е), капсулы 200 МЕ
15. Церебролизин, ампулы 1 мл
16. Циннаризин, таблетки 25 мг
Индикаторы эффективности лечения:
1. Улучшение двигательной активности.
2. Улучшение мышечного тонуса.
3. Повышение силы мышц.
4. Приобретение навыков самообслуживания.
5. Улучшение эмоционального и психического тонуса ребенка.
Госпитализация
Показания к госпитализации (плановая): двигательные расстройства, мышечная слабость, ослабление или отсутствие сухожильных рефлексов, нарушение движений, походки, костные деформации.
Информация
Источники и литература
Информация
Список разработчиков:
Разработчик
Место работы
Должность
Балбаева Айым Сергазиевна
РДКБ «Аксай», психоневрологическое отделение №3
Кадыржанова Галия Баекеновна
РДКБ «Аксай», психоневрологическое отделение №3
Мухамбетова Гульнара Амерзаевна
Кафедра нервных болезней, КазНМУ
Ассистент, кандидат медицинских наук
Серова Татьяна Константиновна
РДКБ «Аксай», 1 п/неврологическое отделение
Миопатия врожденная что это
Врожденные миопатии клинически характеризуются гипотонией и слабостью, обычно наблюдаемыми с рождения, и морфологическими изменениями при гистологических исследованиях и/или электронной микроскопии. Гистопатологические признаки мышечной дистрофии отсутствуют, уровень креатинкиназы (КК) нормальный или слегка повышен, результаты ЭМГ нормальные или свидетельствуют о миопатии. Отмечается широкая вариабельность степени тяжести клинических проявлений внутри каждой формы миопатии и значительное наложение клинической картины других нейромышечных расстройств, в том числе мышечных дистрофий, метаболических миопатий и спинальных мышечных атрофий, а также синдрома Прадера-Вилли, который тоже может дебютировать у новорожденных выраженной гипотонией («гипотоничный младенец»).
Некоторым врожденным миопатиям дано четкое клиническое, морфологическое и генетическое определение. Некоторые определены по специфическим структурным нарушениям, но до сих пор не подтверждены генетическими исследованиями, что препятствует их выделению в отдельную нозологическую форму.
Несмотря на успехи молекулярной генетики, диагноз обычно ставится на основании результатов исследования биоптата мышечной ткани, и, поскольку, в отличие от мышечных дистрофий, клинические картины различных расстройств накладываются одна на другую, направление пациента сразу на анализ ДНК в настоящее время не имеет практического значения.
В настоящее время нет способов излечения врожденных миопатий, но междисциплинарный подход к ведению таких больных может значительно повысить как качество, так и сроки их жизни — в частности, физио- и трудотерапия, ортопедическое лечение, контроль нарушений дыхания и коррекция трудностей кормления. Иногда болезнь протекает относительно доброкачественно, но часто больной становится тяжелым инвалидом, или даже умирает в детском возрасте. Для нескольких из этих расстройств отсутствуют методы пренатальной диагностики. Вебсайт, содержащий информацию о применяемых генетическом тестах: www.geneclinics.org.
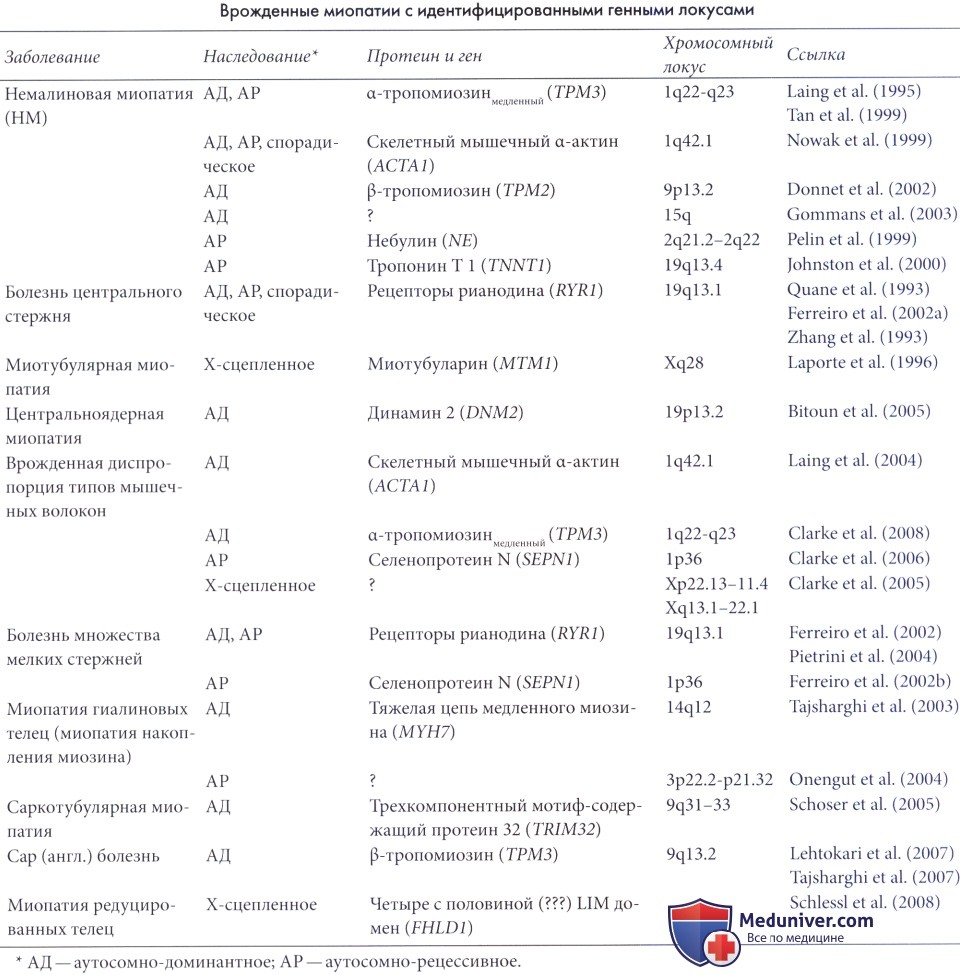
а) Немалиновая миопатия. «Типичная врожденная» форма немалиновой миопатии обычно проявляется при рождении или в первый год жизни гипотонией, слабостью и трудностями при кормлении. У некоторых детей она проявляется позже задержкой двигательного развития, утиной походкой или нарушениями речи, тогда как в некоторых случаях болезнь не проявляется до достижения взрослого возраста. Часто наблюдается слабость мышц лица. Одинаково часто развивается слабость дистальных и проксимальных отделов конечностей. Всегда поражается дыхательная мускулатура, и хотя гиповентиляция может протекать субклинически, нередко возникает необходимость в активной искусственной дыхательной поддержке. Патология сердца наблюдается редко. Заболевание часто протекает статично или прогрессирует очень медленно, и большинство пациентов смогут вести активный образ жизни (Ryan et al., 2001).
Тяжелая врожденная форма немалиновой миопатии проявляется с рождения тяжелой степенью гипотонии и мышечной слабости, малым объемом спонтанных движений, нарушениями сосания и глотания и дыхательной недостаточностью. Эти больные часто умирают в первые недели или месяцы жизни из-за дыхательной недостаточности или рецидивирующей пневмонии, хотя некоторые пациенты выживают и обретают способность ходить (Ryan et al., 2001).
Диагностические признаки немалиновой миопатии — это наличие четких палочковидных включений — немалиновых тел в волокнах скелетной мускулатуры. Палочки не видны при окраске гематоксилином-эозином, но становятся заметными как красные или лиловые структуры на сине-зеленом фоне миофибрилл при трехцветной окраске в модификации Гомори. Считается, что эти включения являются производными боковых расширений Z-линии. Дополнительные патологические признаки включают преобладание волокон I типа, атрофию и/или гипертрофию волокон (Ryan et al., 2003).
Немалиновая миопатия может наследоваться как аутосомно-доминантное, аутосомно-рецессивное или спорадическое состояние (включая новые доминантные мутации). За последние девять лет были открыты мутации пяти новых генов. Все эти гены кодируют протеиновые компоненты тонких мышечных филаментов: α-тропомиозинмедленный, небулин, скелетный α-актин, β-тропомиозин и тропонин Т. Рецессивные мутации небулина, вероятно, вызывают заболевание почти в 50% случаев. Спорадические или новые доминантные мутации в гене скелетного а-актина (AСТА1) вызывают 20-25% случаев (и почти 50% смертей новорожденных).
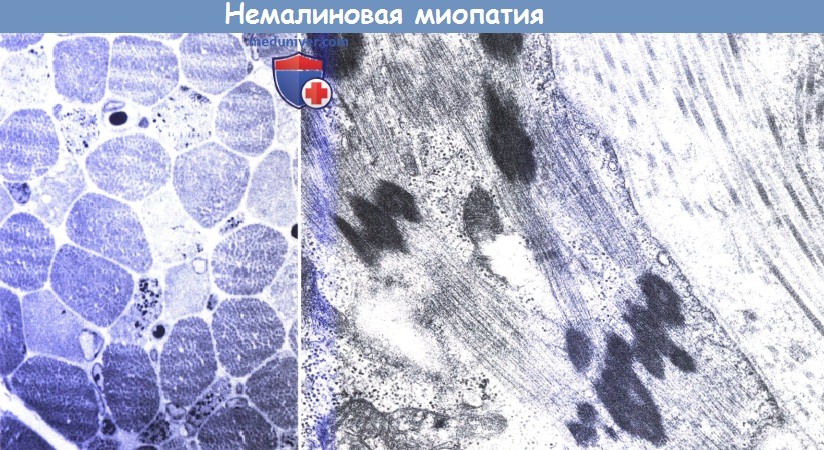
Полутонкий срез окрашенный толуидиновым синим. Палочкообразные структуры видны в многочисленных, чаще всего атрофичных, ангулярных волокнах.
Детская форма (справа), электронная микроскопия (х47,000). Эозинофильные неорганизованные структуры протеина Z-полосы.
б) Болезнь центрального стержня (БЦС). Болезнь центрального стержня (БЦС) обычно манифестирует в младенческом возрасте слабостью и гипотонией, проявляясь, прежде всего, поражением мышц проксимальных отделов/нижних конечностей и малой мышечной массой. Большинство пациентов способно к самообслуживанию. Двигательное развитие обычно протекает с задержкой, но мышечная слабость обычно не прогрессирует или прогрессирует медленно. Может наблюдаться небольшая слабость мышц лица и шеи. Экстраокулярные мышцы обычно интактны. Часто развиваются мышечноскелетные деформации, такие, как кифосколиоз, врожденный вывих бедра, полая стопа или плоскостопие и деформации грудной клетки. Не характерна выраженная дыхательная недостаточность, патология сердца встречается редко, состояние интеллекта не нарушено (Shuaib et al., 1987).
Хотя у большинства пациентов развивается «типичный» клинический фенотип, центральные стержни могут встречаться и при отсутствии клинических проявлений у пациентов с невыраженной слабостью и легкими скелетными деформациями; единственным проявлением заболевания может быть также повышение уровня сывороточной КК (Shuaib et al., 1987; Quinlivan et al., 2003). Недавно, после выявления детей с доминантным или рецессивным БЦС, клинический спектр БЦС был расширен; у них болезнь проявлялась артрогрипозом, тяжелой мышечной слабостью и дыхательной недостаточностью в неонатальном периоде (Romero et al., 2003). У нескольких пораженных детей также описаны офтальмоплегия и птоз. Таким пациентам с самого рождения может понадобиться респираторная поддержка, но у выживших детей с возрастом могут значительно улучшиться дыхательные функции и увеличиться мышечная сила (Romero et al., 2003).
Болезнь центрального стержня (БЦС) традиционно считалась аутосомно-доминантным заболеванием с вариабельной пенетрантностью. Относительно часто встречаются мутации de novo, особенно в тяжелых случаях (Ferriero et al., 2002а; Romero et al., 2003). Большинство случаев болезни центрального стержня вызваны мутациями гена RYR1 хромосомы 19ql3.1 (Quane et al., 1993; Zhang et al., 1993; Ferriero et al., 2002a; Romero et al., 2003). Ген RYR1 кодирует рианодиновый рецептор, регулирующий выход кальция из саркоплазматического ретикулума в саркоплазму, вызывая мышечное сокращение. БЦС аллельна злокачественной гипертермии, и поэтому необходимо соблюдать осторожность при анестезиологическом обеспечении всех пациентов с мышечной слабостью неясной этиологии и вероятным аутосомно-доминантным наследованием.
У некоторых пациентов со злокачественной гипертермией при исследовании биоптата мышцы выявляются центральные стержни, хотя мышечная сила у них остается нормальной.
Характерная аномалия при болезни центрального стержня (БЦС) — наличие центральных стержней: единичных, четко очерченных округлых зон в центре большинства волокон I типа. Стержни являются зонами сниженной окислительной активности ферментов, негативными при окраске на фосфорилазу и гликоген (Shy и Magee 1956; Quinlivan et al., 2003). В стержнях отсутствуют митохондрии и саркоплазматический ретикулум (Quinlivan et al., 2003). В большинстве случаев преобладают волокна I типа.
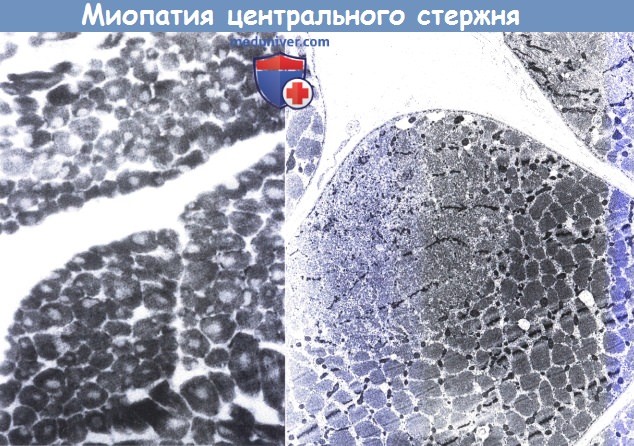
Обратите внимание на однотипность волокон (I типа) и наличие четкой центральной зоны, где отсутствует ферментная активность практически во всех волокнах (слева) (НАД-Нх 150).
При электронной микроскопии (справа) видно, что в «зоне стержня»
(которая в донном конкретном волокне смещена к периферии, а не находится в центре) отсутствуют нормальные мышечные фибриллы и митохондрии; также видна дезорганизация миофиламентов (х23,000).
в) Миотубулярная и центронуклеарная миопатия. На основании клинических и генетических признаков выделяют три группы миотубулярных (центронуклеарных миопатий). Лучше других клинически и генетически определена Х-сцепленная рецессивная форма. Заболевание обычно манифестирует во внутриутробном периоде, течение беременности осложняется многоводием. В анамнезе по материнской линии могут быть случаи невынашивания и смерти новорожденных мужского пола. У пораженных младенцев мужского пола с рождения наблюдаются тяжелые общая гипотония и мышечная слабость, лицевая диплегия, трудности при дыхании и кормлении. Дополнительные признаки включают в себя тонкие ребра, контрактуры тазобедренных и коленных суставов, толстые отечные веки, офтальмоплегию и крипторхизм. Многие больные мальчики умирают в неонатальном периоде, но небольшое число больных живет в течение длительного времени; последним часто требуется постоянная дыхательная поддержка (McEntagart et al., 2002).
Ген Х-сцепленной миотубулярной миопатии, МТМ1, локализуется в хромосоме Xq28 (Laporte et al, 1996), считается, что он участвует в пути сигнальной трансдукции, необходимом в процессе позднего миогенеза. Основное заболевание, с которым проводится дифференциальная диагностика,— врожденная миотоническая дистрофия — исключается на основании клинической картины и генетических исследований.
Аутосомная форма миотубулярной миопатии известна как центронуклеарная миопатия и встречается крайне редко. Аутосомно-рецессивная форма центронуклеарной миопатии обычно манифестирует в младенческом возрасте или раннем детстве респираторным дистрессом, гипотонией, тихим криком и нарушением сосания. Часто наблюдаются офтальмоплегия, птоз и лицевая диплегия. Клиническое течение характеризуется задержкой двигательного развития, медленно прогрессирующей слабостью, развитием сколиоза. По достижении подросткового возраста многие пациенты прикованы к инвалидному креслу (Jeannet et al., 2004). Хромосомный локус рецессивной формы центронуклеарной миопатии до сих пор не известен. Аутосомно-доминантные и спорадические формы болезни обычно дебютируют в детстве, подростковом или взрослом возрасте, и имеют значительно более легкий фенотип и более медленно прогрессирующую мышечную слабость и истощение; часто наблюдаются птоз и ограничение подвижности глаз.
Мутации, вызывающие заболевание, были недавно обнаружены в гене, кодирующем динамин 2 (Bitoun et al., 2005).
Характерные гистологические признаки — это преобладание маленьких волокон I типа с центрально расположенными ядрами, напоминающими фетальные миотубы (North, 2004). Обычно наблюдается агрегация митохондрий в центре мышечного волокна, сопровождаемая плотным окрашиванием окислительных ферментов и отсутствием окрашивания миозин аденозин трифосфатазы (АТФ-азы). Радиальное расположение саркоплазматических тяжей при окислительном окрашивании может быть характерным признаком этого заболевания (Jeannet et al., 2004). Облигатное носительство Х-сцепленных форм миотубулярной миопатии обычно протекает бессимптомно, но до 50% таких носителей имеют типичные изменения в биоптате мышечной ткани.
г) Многострежневая миопатия. Многострежневая миопатия — клинически гетерогенное заболевание. Примерно у 75% пациентов наблюдается «классическая» форма расстройства, манифестирующая в течение первого года жизни. Больные младенцы гипотоничны и слабы, отмечается гиперподвижность суставов и задержка двигательного развития. Наблюдается слабость преимущественно аксиальной мускулатуры; в наибольшей степени поражаются мышцы-сгибатели шеи, что приводит к снижению или отсутствию контроля головки у младенцев. Часто развиваются кифосколиоз и ригидность позвоночника, которые могут быстро прогрессировать в периоды быстрого роста скелета, особенно в подростковом возрасте. Этим процессам может сопутствовать дыхательная недостаточность, которая также может развиться в короткие сроки (Ferreira et al., 2000; Jungbluth et al., 2000).
Почти у двух третей пациентов с классической формой болезни множества мелких стержней в позднем подростковом периоде или в раннем взрослом возрасте развивается дыхательная недостаточность, хотя многие из них сохраняют способность к самообслуживанию (Ferreira et al., 2000). Часто наблюдается слабость мышц лица, но экстраокулярные мышцы сохранны. Интеллект нормальный. Болезнь множества мелких стержней также может проявляться легкой слабостью дистальных отделов верхних конечностей с амиотрофией кисти и выраженной гиперподвижностью суставов. Поражение нижних конечностей не тяжелое, отмечается слабость в проксимальных мышцах поясницы и таза. При этой легкой форме выраженность сколиоза и нарушения дыхания минимальны или вовсе отсутствуют (Ferriero et al., 2000).
Редко болезнь множества мелких стержней может проявляться наружной офтальмоплегией и слабостью мышц проксимальных отделов конечностей (Jungbluth et al., 2000) или в неонатальном периоде множественным врожденным артрогрипозом (Ferriero et al., 2000).
Мелкие стержни выявляются в препаратах на АТФ-азу в виде множественных фокальных дефектов окислительной активности ферментов в большинстве волокон; они встречаются как в волокнах 1, так и 2 типа (Ferriero et al., 2000; Jungbluth et al., 2000). Этим изменениям сопутствует увеличение вариабельности размера волокон, наличие центральных ядер, гипотрофия и преобладание волокон I типа (Jungbluth et al., 2000). Дистрофические изменения иногда наблюдаются у пациентов с болезнью множества мелких стержней, вызванной мутациями SEPN1 (Ferriero et al., 2002b).
Было выявлено, что мутации двух генов вызывают примерно 50% случаев болезни множества мелких стержней. Рецессивные мутации SEPN1, гена селенопротеина N, вызывают 30% случаев, особенно часто — случаи с ранним тяжелым кифосколиозом и высоким риском развития дыхательной недостаточности (Ferriero et al., 2004). Различные мутации того же гена вызывают мышечную дистрофию ригидного позвоночника (Moghadazadeh et al, 2001), десмин-связанную миопатию с тельцеподобными включениями Mallory (Ferriero et al. 2004) и врожденную диспропорцию типов волокон (Clarke et al., 2006). Клинические картины всех этих состояний очень похожи, несмотря на различные патологические изменения мышц.
Рецессивные мутации в гене мышечного рианодина (RYR1) имеются у небольшого количества пациентов (Pietrini et al., 2004), и опубликовано единственное сообщение о доминантной мутации RYR1, вызвавшей дебютировавшую у взрослого болезнь множественных мелких стержней (Ferriero et al., 2002а). Пациенты с болезнью множественных мелких стержней, вызванной мутацией RYR1, имеют высокий риск развития злокачественной гипертермии (Guis et al., 2004).
д) Врожденная диспропорция типов мышечных волокон (ВДТМВ). Термин врожденная диспропорция типов мышечных волокон (ВДТМВ) впервые был впервые предложен Brooke в 1973 г. в докладе о группе из 12 детей с гипотонией, признаками врожденной миопатии, и определенными гистологическими аномалиями. Определяющей аномалией при световой микроскопии было различие в размерах мышечных волокон 1 типа (медленное сокращение) и 2 типа (быстрое сокращение), первые оказались минимум на 12% меньше последних (Brooke и Engel, 1969). Гистологические изменения были названы диспропорция размеров волокон (ДРВ).
Диспропорция размеров волокон (ДРВ) как вторичный феномен может наблюдаться и при другой клинической картине при самых разнообразных скелетных и нейромышечных расстройствах, включая расстройства ЦНС, периферическую нейропатию, мышечную дистрофию ЦНС, периферическую нейропатию, мышечную дистрофию и другие врожденные миопатии, такие, как немалиновая миопатия, болезнь множественных мелких стержней и центронуклеарная миопатия. В результате ВДТМВ — это диагноз исключения, который выставляется пациентам с клиническими проявлениями врожденной миопатии, у которых единственной выявленной гистологической аномалией является уменьшение размера мышечных волокон 1 типа по сравнению с волокнами 2 типа (Bodensteiner, 1994; Clarke и North, 2003).
У большинства пациентов с ВДТМВ с рождения наблюдается гипотония, мышечная слабость, уменьшающаяся с возрастом, маленький рост, низкая масса тела, множественные контрактуры суставов (особенно врожденный вывих бедра и эквиноварусная косолапость), сколиоз, длинное тонкое лицо, высокое небо и изогнутая верхняя губа (Brooke, 1973; Innaccone et al., 1987). Реже у пациентов с ВДТМВ с детства отмечается медленно прогрессирующая слабость, офтальмоплегия, поражения глотки и сердца, снижение интеллекта и тяжелые прогрессирующие двигательные нарушения с кифосколиозом и дыхательной недостаточностью (Iannaccone et al., 1987; Haltia et al., 1988; Torres и Moxley, 1992; Akiyama и Nonaka, 1996; Banwell et al., 1999).
Врожденная диспропорция типов мышечных волокон (ВДТМВ) является генетически гетерогенным состоянием, сообщалось о семьях с аутосомно-доминан гным и рецессивным наследованием. У пациентов с тяжелой манифестировавшей с рождения мышечной слабостью и поражением дыхательной мускулатуры были выявлены возникшие de novo доминантные мутации гена, кодирующего скелетный а-актин (АСТА1), также связанные с немалиновой миопатией (Laing et al., 2004). Также были выявлены рецессивные мутации гена, кодирующего селенопротеин N (SEPN), связанные с болезнью множественных мелких стержней (Clarke et al., 2006). В дополнение, в семье, в которой у мужчин развивалась тяжелая летальная миопатия, а у женщин-носителей — слабость мышц лица и птоз, был идентифицирован локус Х-хромосомы (Clarke et al., 2006).
е) Миопатия гиалиновых телец (миопатия накопления миозина). Эта редкая врожденная миопатия характеризуется генерализованной мышечной слабостью или слабостью мышц проксимальных отделов и манифестирует в младенческом возрасте, в детстве или, редко, во взрослом возрасте (Masuzugava et al., 1997; Tajsharghi et al., 2003). Гиалиновые тела представляют собой большие зоны, лишенные саркомеров, локализующиеся на периферии мышечного волокна, содержащие мелкогранулированный материал, где после обработки кислотой выявляется активность миофибриллярной АТФ-азы. Сопутствующие патологические изменения включают в себя диспропорцию типов мышечных волокон, преобладание волокон 1 типа.
Аутосомно-доминантная миопатия гиалиновых тел (накопления миозина), как было недавно выяснено, вызывается мутациями гена, кодирующего тяжелую цепь медленного миозина MYH7 (Tajsharghi et al., 2003), эти мутации также вызывают семейную гипертрофическую кардиомиопатию (Bonne et al., 1998), и дистальную миопатию Лаинга (Meredith et al., 2004). Рецессивная миопатия гиалиновых телец сцеплена с локусом третьей хромосомы (Onengtit et al., 2004).
ж) Саркотубулярная миопатия. Это редкое рецессивное заболевание, характеризующееся вакуолизацией в мышечных волокнах, видной при световой микроскопии (Jerusalem et al., 1973). Вакуоли связаны с мембраной и, как оказывается, развиваются из саркотубулярной системы. Клинически заболевание проявляется непрогрессирующей слабостью проксимальных отделов, вариабельным поражением сгибателей шеи, мышц лица и дыхательной мускулатуры, возникающих с рождения. У сиблингов описаны значительно различающиеся по тяжести и времени проявления вызываемой упражнениями миалгии и слабости мышц проксимальных отделов (Muller-Felber et al., 1999). Мутации, вызывающие заболевание, были идентифицированы в гене TRIM32, который также связан с одной из форм конечностно-поясничной мышечной дистрофии (КПМД 2Н).
з) Синдром Маринеску-Шегрена (СМШ). Синдром Маринеску-Шегрена (СМШ) — давно описанное аутосомно-рецес-сивное мультисистемное заболевание, проявляющееся с младенческого возраста атаксией вследствие мозжечковой дисплазии, умственной отсталостью слабой или средней степени, миопатией, мышечной слабостью и маленьким ростом. Описаны дополнительные симптомы, а именно скелетные аномалии и гипергонадотропный гипогонадизм. Заболевание обычно становится заметным на поздних стадиях из-за поражения мышц, характеризующегося генерализованными гипотонией и слабостью, и миопатической ЭМГ (Zimmer et al., 1992). Электронное микроскопическое исследование биоптата мышечной ткани выявило плотную мембранозную структуру, окружающую ядра мышечных волокон и являющуюся характерным ультраструктурным признаком СМШ (Sewry et al., 1988).
После идентификации вызывающей заболевание мутации гена SIL1, ключевого регулятора основных функций эндоплазматического ретикулума, СМШ был включен в число болезней дисфункций эндоплазматического ретикулума, что указывает на роль этой органеллы в развитии мультисистемных заболеваний (Senderek et al., 2005).
Редактор: Искандер Милевски. Дата публикации: 14.1.2019