Миопическая макулопатия глаза что это
Что такое макулодистрофия (возрастная макулярная дегенерация)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Казанцевой Е. И., офтальмолога со стажем в 5 лет.
Определение болезни. Причины заболевания
Макулодистрофия (макулярная дегенерация, или макулопатия) — это обширная группа хронических прогрессирующих заболеваний, при которых постепенно поражается центральная зона нервной ткани глаза — макулярная область сетчатки. Сопровождается снижением центрального зрения. Как правило, поражает оба глаза.
В основном данное заболевание поражает женщин, причём после 75 лет оно встречается в два раза чаще. Причина такой закономерности пока неизвестна.
Вероятность развития дистрофии повышается у людей, которые употребляют больше насыщенных жиров и холестерина, а также при высоком индексе массы тела. Ниже риск разрушения макулы у людей, потребляющих достаточное количество омега-3 полиненасыщенных жирных кислот — содержатся в морской рыбе, мясе диких животных, морских водорослях и др.
Симптомы макулодистрофии
При возрастной макулодистрофии зрение снижается постепенно и безболезненно в течение нескольких лет. Пациенты замечают снижение остроты зрения, которое не получается скорректировать подбором очков. Также появляются жалобы на затуманивание зрения, трудности при чтении, снижение контрастной чувствительности, особенно в помещении с плохим освещением или в сумерках.
Иногда при запущенных стадиях центральное зрение снижается до такой степени, что пациенты видят лишь боковым зрением или эксцентрично, а в центре — только чёрное или серое пятно.
Патогенез макулодистрофии
Несмотря на многочисленные исследования возрастной макулодистрофии, патогенез этого заболевания до сих пор остаётся невыясненным. Но часть основных звеньев патогенеза всё же изучена.
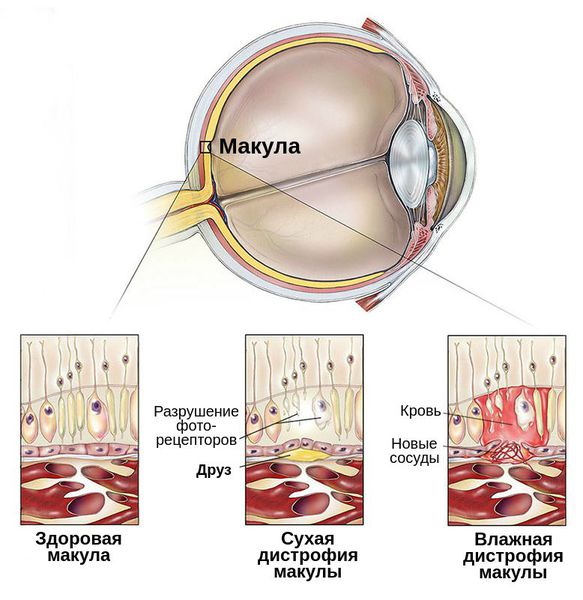
C возрастом между слоями сетчатки откладываются продукты жизнедеятельности фоторецепторов — липофусцин, или пигмент «старости». Их называют друзами. Они возникают из-за ухудшения питания тканей и замедленного выведения из них продуктов обмена.
Далее патогенез может пойти по одному из путей:
Все эти процессы протекают с выраженной дисфункцией макулы и резким ухудшением центрального зрения.
Классификация и стадии развития макулодистрофии
Разные подходы и взгляды на патогенез макулодистрофии, развитие методов диагностики стали причиной появления нескольких вариантов классификаций возрастной макулодистрофии.
Одна из международных классификаций была принята в 1995 году. В ней разделяли обширное понятие «возрастная макулодистрофия» следующим образом:
Но большинство офтальмологов в России используют в своей практике классификацию макулодистрофии, основанную на этапах развития дистрофического процесса. Кацнельсон Л. А. с соавторами выделяют три формы (стадии) заболевания [9] :
Осложнения макулодистрофии
Так как заболевание на начальных стадиях протекает практически бессимптомно, очень высок риск того, что впервые макулодистрофия обнаружится только тогда, когда сетчатка уже будет достаточно повреждена. Это состояние будет сопровождаться стойким снижением остроты и качества центрального зрения.
К тому же при нерегулярных осмотрах врача-офтальмолога можно пропустить переход возрастной макулодистрофии из сухой формы во влажную, из-за чего пациент не получит своевременное и эффективное лечение.
Диагностика макулодистрофии
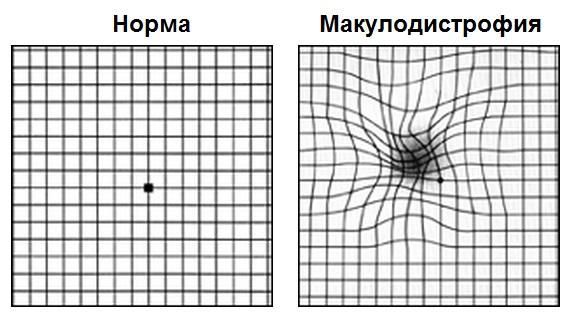
Первым этапом диагностики является самодиагностика с помощью теста Амслера. Для этого пациент располагает тест на расстоянии 15-20 см от лица, сосредотачивает свой взгляд на центральной точке, прикрывает ладонью один глаз и оценивает квадраты и линии вокруг точки: есть ли искривления, искажения, все ли квадраты одинаковое или появились серые пятна. Потом тоже самое он повторяет и для второго глаза.
Такой периодический самоконтроль должен проводить каждый пациент с сухой формой возрастной макулодистрофии. При первых признаках искажений линий требуется немедленное обратиться к специалисту.
На картинке справа проиллюстрировано то, как видит тест Амслера пациент с сухой макулодистрофией развитой стадии или с рисками перехода из сухой формы во влажную; слева — зрение пациента без макулодистрофии или на начальных стадиях сухой формы болезни.
В целом диагностика возрастной макулодистрофии базируется на основных и дополнительных методах исследования.
Основные данные врач получает при стандартном офтальмологическом осмотре:
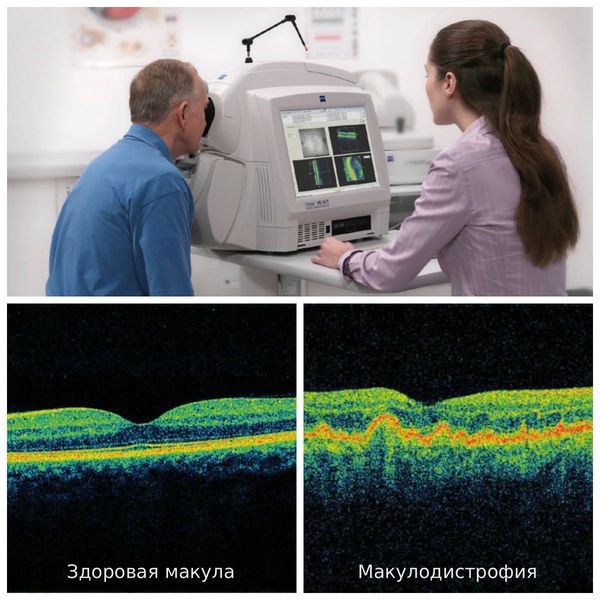
К дополнительным методам диагностики относятся:
Наиболее информативными методами выявления патологии сетчатки являются флуоресцентная ангиография и ангиография с индоцианином зелёным. Они визуализируют новообразованные сосуды, состояние пигментного эпителия и кровеносного русла глазного дна в целом. Для проведения этих двух методик использую различные модели фотокамер, а также флуоресцеин или индоцианин зелёный, которые вводят внутривенно перед исследованием. Однако при планировании и проведении данных манипуляций стоит помнить, что эти препараты могут вызывать аллергические реакции и другие побочные эффекты. Поэтому отбор пациентов для таких видов исследований должен быть тщательным.
Противопоказания к ангиографии:
Лечение макулодистрофии
В России есть зарегистрированные витаминно-минеральные комплексы, в которых содержатся каротиноиды, экстракт плодов черники, цинк, витамины А, С, Е. Они предназначены для профилактики возникновения макулодистрофии (если есть риск) и при начальных этапах развития болезни в качестве заместительной терапии.
Для того, чтобы данные витаминно-минеральные комплексы работали, необходимо, чтобы все компоненты находились в правильных пропорциях: лютеин — минимум 2 мг, антоцианы — минимум 10 мг, цинк — более 10 мг, медь — менее 1 мг.
Как показали результаты всемирных клинических исследований, анти-VEGF препараты эффективны в отношении остроты зрения по сравнению с другими методами лечения — использования глюкокортикостероидов, лазерного лечения и др. Поэтому они заслуженно стали препаратами первой линии выбора при лечения влажной макулодистрофии, причиной которой является образование новых кровеносных сосудов.
Прогноз. Профилактика
Пациентам с сухой возрастной макулодистрофией рекомендуется принимать добавки с антиоксидантами — каротиноиды, витамины, микроэлементы. При лечении влажной формы болезни одним из главных и решающих факторов является время, так как перспектива лечения будет напрямую зависеть от своевременно начатой эффективной терапии, т. е. от начала постановки ингибиторов VEGF. Чем раньше начато правильное лечение, тем лучше результат. Терапевтическим окном считают один год от начала заболевания. Важен ежемесячный мониторинг показателей остроты зрения, данных ОКТ и биомикроофтальмоскопии для оценки необходимости повторных инъекций после стандартной «загрузочной дозы».
Стандартное ведение сухой возрастной макулодистрофии предполагает самоконтроль пациента с помощью теста Амслера, регулярные осмотры один раз в 6-12 месяцев с контролем остроты зрения и проведением биомикроофтальмоскопии, а также приём антиоксидантов. Регулярные осмотры позволят как можно раньше выявить признаки перехода болезни из сухой формы во влажную.
Курсовое лечение сухой макулодистрофии в условиях стационара не имеет смысла, так как весь объём наблюдений и необходимой замещающей терапии можно выполнять на уровне поликлиники.
Для профилактики возрастной макулодистрофии требуется ещё в молодом возрасте исключить факторы риска: курение, наличие в рационе большого количества насыщенных жирных кислот, избыточную инсоляцию. Если факторы риска не удалось исключить, то после 50-ти лет нужно начинать профилактический приём витаминно-минеральных комплексов с каротиноидами.
Макулодистрофия – симптомы и лечение возрастной болезни, факторы риска, кто болеет
Оглавление
Возрастная макулодистрофия сетчатки является одной из самых частых причиной потери центральной остроты зрения у людей пожилого возраста во всем мире.
Что такое макула?
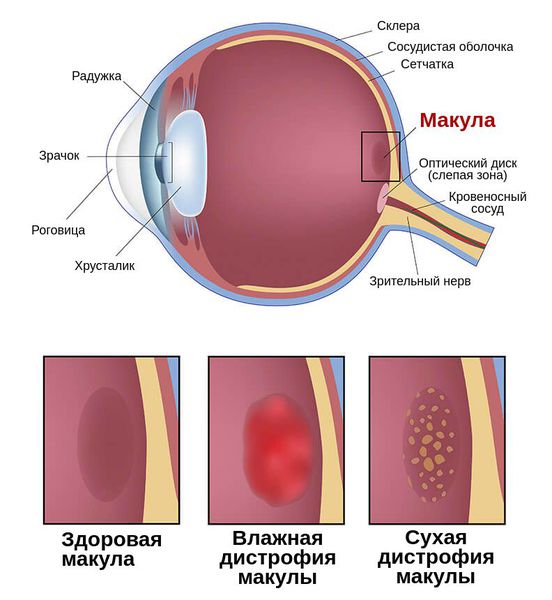
Макула – это центральная часть светочувствительного слоя глаза – сетчатки. Заболевания макулы приводят к снижению или потере центральной остроты зрения. Снижается способность человека видеть мелкие предметы, читать, писать, различать цвета.
Что такое макулодистрофия сетчатки?
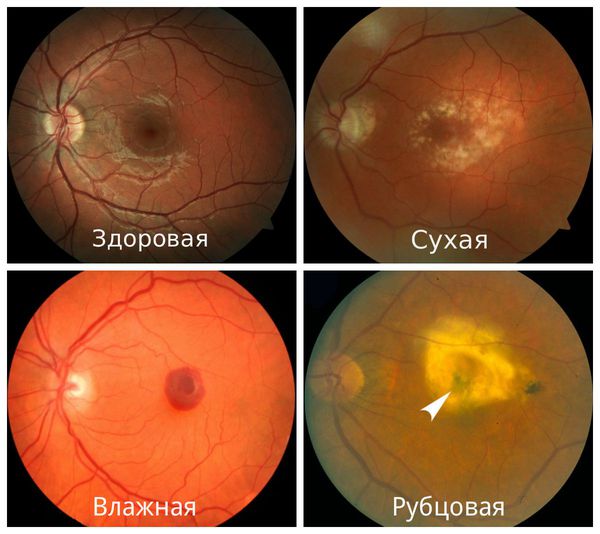
Макула состоит из нежных, светочувствительных клеток. В результате определенных процессов эти клетки могут повреждаться, такое состояние называется «макулодистрофия сетчатки». Чаще всего это состояние возникает в пожилом возрасте и его называют «сенильная макулодистрофия сетчатки». Офтальмологи делят макулодистрофию на 2 формы – «влажную» и «сухую».
«Сухая» макулодистрофия встречается чаще, развивается она медленно, вызывая снижение центрального зрения. «Влажная» макулодистрофия как правило бывает следующим этапом течения процесса. Причина ее развития – образование новых кровеносных сосудов за сетчаткой (такой процесс называется «неоваскуляризацией»). Новые сосуды получаются хрупкими и проницаемыми для крови, а это ведет к появлению кровоизлияний, образованию соединительной ткани и, в итоге – к потере зрения. «Влажная» макулодистрофия развивается быстро, ведет к значительной потере центрального зрения.
Обычно макулодистрофия сетчатки поражает оба глаза, но часто один глаз начинает терять зрение намного раньше другого – в таком случае пациент может не заметить начало болезни сразу, т.к. один глаз компенсирует потерю функции второго.
Доктор, я ослепну?
Макулодистрофия не приводит к полной слепоте, т.к. поражется только центральное зрение. Периферическое поле зрения не страдает, что дает возможность довольно неплохо ориентироваться в пространстве.
В чем причина болезни?
В настоящее время имеется несколько теорий возникновения данного заболевания, однако точная причина малокудистрофии не известна. Факторами риска развития заболевания можно назвать следующие состояния параметры:
Симптомы макулодистрофии
На ранних стадиях макулодистрофия пациенты отмечают ухудшение центрального зрения, предметы выглядят искаженно, а прямые линии кажутся изогнутыми. Развитие симптомов может быть постпенным – в течение нескольких месяцев или быстрым. Иногда появляется резкая чувствительность к свету. Болей не бывает. На поздних стадиях больные жалуются на темное пятно в центральной части поля зрения, затрудняющее чтение, вождение автомобиля и работу с мелкими предметами. Снижение или изменение цветовосприятия.
Как диагностируется макулодистрофия?
Обычно диагноз трудностей не представляет. После проведения инструментального обследования органа зрения и осмотра глазного дна офтальмолог поставит диагноз. Иногда требуются дополнительные методы исследования (флюоресцентная ангиография, оптическая когерентная томография и пр.), которые, в случае необходимости, Вам порекомендует врач. Чем раньше проводится диагностика макулодистрофии, тем лучше, т.к. это поможет предотвратить потерю зрения, а также снизить риск возможных осложнений.
Лечение макулодистрофии
В настоящее время эффективное лечение сухой формы макулодистрофии еще не разработано, однако было показано, что правильное питание, включение в рацион большого количества свежих овощей и фруктов, витамины А и Е, являющиеся антиоксидантами, могут замедлить или даже предотвратить развитие болезни.
Что касается влажной формы – существует несколько методик и несколько современных препаратов, которые помогают справиться с новообразованными сосудами в макулярной области, уменьшить кровоизлияния и отек сетчатки. Рекомендации в каждом конкретном случае дает врач в соответствие с особенностями заболевания.
Профилактика возникновения макулодистрофии:
Прогноз
К сожалению, макулодистрофия со временем может появиться вновь, несмотря на успешное ее лечение. Людям с повышенным риском следует проходить регулярное обследование у врача-офтальмолога. Различные процедуры могут значительно замедлить или остановить прогрессирование заболевания.
Миопическая макулопатия глаза что это
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
ФГБУ «НИИ глазных болезней» РАМН, Москва
Современный взгляд на миопическую макулопатию
Журнал: Вестник офтальмологии. 2016;132(1): 85-90
Жабина О. А., Вудс Е. А., Плюхова А. А. Современный взгляд на миопическую макулопатию. Вестник офтальмологии. 2016;132(1):85-90.
Zhabina O A, Woods E A, Pliukhova A A. Modern views on myopic maculopathy. Vestnik Oftalmologii. 2016;132(1):85-90.
https://doi.org/10.17116/oftalma2016132185-90
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
Темпы роста заболеваемости миопией признаются большинством ученых мира социально значимой проблемой, поскольку при этом увеличивается и риск развития осложненной миопии, часто приводящей к инвалидизации молодого работоспособного населения. С использованием текстовых баз данных PubMed, eLIBRARY и Scopus проанализирован 61 источник отечественной и зарубежной литературы, посвященный проблеме осложненной миопии и миопической макулопатии, историческим фактам изучения данной проблемы, некоторым этиологическим факторам развития заболевания и принципам классификации миопической макулопатии. В статье рассмотрены различные подходы к лечению хориоидальной неоваскуляризации (ХНВ) как частого осложнения миопической макулопатии, в том числе применение анти-VEGF-терапии, а также возможные осложнения этого лечения. На сегодняшний день накоплен большой клинический опыт по изучению различных форм миопической макулопатии. Однако остаются вопросы, которые, вполне возможно, удастся решить с применением новых технологий прижизненного, детального изучения как склеральной, так и сосудистой оболочки миопического глаза. Наиболее эффективным методом лечения ХНВ на фоне миопической макулопатии в настоящее время признана анти-VEGF-терапия, однако в связи с этим требуется систематизировать подход к отбору пациентов, проведению инъекций и ведению пациентов после терапии.
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
ФГБУ «НИИ глазных болезней» РАМН, Москва
В современном мире значительно усилились темпы роста заболеваемости миопией вне зависимости от стран и популяций. За последние 30 лет в США заболеваемость увеличилась с 25 до 41% [1], а в азиатских странах до 70—90% [2, 3]. Миопия высокой степени развивается в 27—33% случаев среди всех пациентов с миопией. В США это 1,7—2% от общей численности населения, в Японии — 6—18% от всех миопов и 1% от общей численности населения [4, 5]. В Китае в 1988 г. более 80% детей в возрасте 6 лет и около 30% в возрасте 17 лет не имели миопической рефракции. К 2007 г. — уже 60% 6-летних и около 10% 17-летних детей [6].
В связи с ростом миопии высокой степени возрастает риск развития осложненной миопии, регматогенной отслойки сетчатки и глаукомы [1, 7]. Большинство исследователей признают, что миопия становится социально значимой проблемой: так, в мире насчитывается 153 млн инвалидов по зрению из-за данного заболевания, что составляет 49% всех инвалидов по зрению [8]. В случае развития субретинальной неоваскулярной мембраны (СНМ) или хориоидальной неоваскуляризации (ХНВ) прогноз по зрению неутешителен. Так, при 10-летнем наблюдении пациентов с миопией, осложненной СНМ, острота зрения в 96,3% случаев снижается до 0,01 [9]. В России в структуре инвалидности вследствие офтальмопатологии осложненная миопия занимает 2-е место (19%), распространенность инвалидности вследствие близорукости составляет от 0,4 до 15,0 случаев на 10 000 населения с вариацией в разных возрастах. Среди инвалидов вследствие близорукости 93% — это люди трудоспособного возраста [10—13].
SNPs, найденные в обширных полногеномных исследованиях, до сих пор не могут полностью объяснить наследуемость, рассчитанную в семейных и близнецовых исследованиях. Поэтому целью японского исследования M. Miyake и K. Yamashiro [16] было установить, могут ли SNPs объяснить наследуемость величины ПЗО и рефракции. Был проанализирован 2171 человек из проживающих в японском городе Нагахама, генотипированный по 1,751,558 SNPs. В результате наследуемость величины ПЗО и рефракции (± стандартная ошибка) объяснялась всеми выявленными SNPs в 40,0% (±21,2) и 61,1% (±24,8) соответственно. Наибольшее влияние на ПЗО имели гены на 1-й хромосоме (11%), тогда как на хромосомах 3,7 и 11 таких генов не было найдено. Меньшая величина наследуемости по сравнению с таковой в семейных и близнецовых исследованиях может объясняться наличием редких вариантов и структурной вариабельности.
Помимо возраста, пола, этнической принадлежности, уровня интеллекта, количества прочитанных книг в неделю, скорости роста, еще одними факторами риска развития и прогрессирования миопии являются ухудшение экологической ситуации и урбанизация. Положительное влияние пребывания детей на свежем воздухе было доказано рядом крупных исследований в Австралии и США [17, 18]. Разные цифры распространенности миопии среди маленьких китайцев в Сингапуре и Сиднее (29,1 и 3,3%) подтолкнули к детальному анализу факторов риска, в результате чего обнаружено существенное влияние времени пребывания детей на свежем воздухе на данные показатели. По результатам исследований I. Morgan и K. Rose [17] сформулировали концепцию развития миопии, по которой любой ребенок, живущий в плохой экологической обстановке, в высоко урбанизированной среде и испытывающий большое давление в связи с образовательным процессом, может стать близоруким.
В настоящее время единой классификации миопической макулопатии не существует. Некоторые классификации, по аналогии с возрастной макулярной дегенерацией, подразумевают сухую и влажную формы в зависимости от наличия СНМ [19, 20].
M. Avila в 1984 г. предложил следующую классификацию [20]:
— М1 — обеднение хориокапиллярной сети, tessellation; задняя стафилома;
— М2 — лаковые трещины;
— М3 — зоны атрофии ретинального пигментного эпителия (РПЭ) и хориокапилляров в макуле;
— М4 — большие поля географической атрофии хориокапиллярного слоя в макуле.
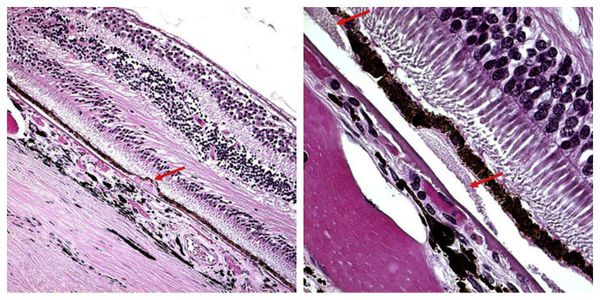
Согласно классификации, предложенной Т. Tokoro [21], выделяют паркетное глазное дно, диффузную хориоретинальную атрофию, очаговую хориоретинальную атрофию, лаковые трещины, СНМ. Лаковые трещины, впервые описанные в 1902 г. Зальцманом, представляют собой разрыв в мембране Бруха, ретинальном пигментном эпителии и хориокапиллярах [22, 23]. Распространенность лаковых трещин у пациентов с миопией высокой степени составляет 4,3—9,2% [5]. Существует два основных типа лаковых трещин — линейные и звездчатые. По мнению Т. Tokoro, лаковые трещины — дефект в РПЭ и мембране Бруха (первично не затрагивающий хориокапилляры) — развиваются как ответ на увеличение длины глазного яблока. В некоторых случаях лаковые трещины ведут к атрофии РПЭ и хориокапилляров, однако именно лаковые трещины занимают первую позицию в частоте развития СНМ [20, 24]. На втором месте — атрофия РПЭ и хориокапилляров. Возможно, атрофия хориокапилляров приводит к ишемии и повышенной выработке фактора роста эндотелия сосудов, а механическое повреждение РПЭ дает зону для роста новообразованных сосудов [5]. При миопии высокой степени и увеличении ПЗО ≥27 мм, происходит формирование дефектов в мембране Бруха, что приводит к потере клеток РПЭ и хориокапилляров. В дальнейшем прогрессирующая атрофия хориокапилляров вызывает заметное разряжение фоторецепторного слоя [25].
В Германии при опросе 340 офтальмологов знания о распространенности заболеваемости, классификации и тактики ведения пациентов с миопией высокой степени, осложненной развитием СНМ, существенно варьировали. Это может быть объяснено не столько различным уровнем специализации офтальмологов, сколько отсутствием единых рекомендаций по диагностике и лечению [26].
История подходов к лечению миопической СНМ сходна с таковой экссудативной ВМД [27—29]. Наиболее ранние работы посвящены изучению эффективности лазеркоагуляции. Учитывая, что 89% мембран были расположены в фовеальной зоне, через 5 лет после лазеркоагуляции острота зрения хотя и была выше, чем в группе без лечения, но отмечалась высокая частота рецидивов — 72%, и в дальнейшем в 36% случаев на повторно пролеченных глазах зрение снижалось до 20/154. А через 10 лет наблюдения различий между глазами без и с лазеркоагуляцией не было [30].
Фотодинамическая терапия (ФДТ), как моно-, так и в комбинации с применением антиангиогенных и стероидных препаратов, позволила стабилизировать остроту зрения, но количество рецидивов вследствие разрушения РПЭ оставалось высоким [31—33]. Выдвигалась гипотеза, что ФДТ может негативно влиять на толщину и перфузию хориоидеи и вызывать рецидивы (около 25%) [34]. В Португалии изучали толщину сетчатки в 3 группах пациентов: в 1-й — 11 глаз (26,2%) — проводили ФДТ с вертепорфином, во 2-й — 9 глаз (21,4%) — эндовитреально вводили ранибизумаб, в 3-й — 8 глаз (19,0%) — применяли комбинацию этих методов лечения. Контролем служили 14 глаз (33,3%) с миопией без СНМ. Несмотря на то что различий между показателями толщины хориоидеи по группам выявлено не было, результаты исследования базируются на малой выборке и небольших сроках наблюдения и не являются высоко достоверными [35].
При комбинировании ФДТ с эндовитреальным введением триамцинолона основную проблему составляют развитие катаракты (20%) и офтальмогипертензия (45%). Интересен тот факт, что темпы прогрессирования катаракты были сопоставимы с таковыми у пациентов с возрастной макулярной дегенерацией (ВМД), а уровень внутриглазного давления был существенно выше. Исследователи связывают данный феномен с молодым возрастом близоруких людей [31, 36, 37].
На 100 глазах (96 пациентов) сравнивали терапевтическую эффективность перорального приема бисфосфоната-алендроната в дозе 5 мг/сут или 35 мг/нед (препарат для лечения остеопороза, имеющий антиангиогенный эффект), эндовитреальной антиангиогенной (анти-VEGF) терапии и фотодинамической терапии. Срок наблюдения составил 2 года. Различий между группами по средней остроте зрения после терапии бисфосфонатом и ФДТ получено не было, при эндовитреальном введении анти-VEGF-препаратов достоверность повысилась (за 2 года наблюдения –0,28, –0,26 и –0,39 LogMAR единиц, р=0,032, 0,021 и 0,0004 соответственно). Среднее уменьшение толщины сетчатки в макулярной зоне составляло –84, –121 и –122 мкм (р=0,0025, 0,017 и 0,000025 соответственно) [38].
Хирургические методы — от резекции СНМ до макулярной транслокации — сложны в исполнении, требуют дорогостоящего оборудования и высокотехнологичного уровня персонала. Все вышеперечисленные факторы и противоречивые результаты не позволили хирургическим методам лечения занять нишу в терапии миопической СНМ [39, 40].
Фактор роста эндотелия сосудов (VEGF), как полагают, играет важную роль в развитии новообразованных сосудов глаза как при диабетической ретинопатии, ВМД, так и при неоваскулярной глаукоме [41—43]. При всех вышеперечисленных состояниях уровень VEGF внутри глаза сильно повышается, что приводит к стимуляции эндотелиальных клеток сосудов к пролиферации [44]. В исследовании T. Wakabayashi и соавт. [45] концентрация VEGF во влаге передней камеры у пациентов с миопией высокой степени (с СНМ и без) была значительно ниже, чем в контроле и сообщениях L. Aiello, O. Sawada и соавт. [41—43]. Концентрация VEGF отрицательно коррелировала с ПЗО. Возможно, VEGF разбавляется из-за большого объема близорукого глаза. Также исследователи определили, что, несмотря на низкий уровень VEGF, у пациентов с СНМ он был выше, чем у пациентов с миопией без СНМ. Кроме того, концентрация VEGF была значительно связана с наличием СНМ в глазах с миопией высокой степени (p=0,325, p=0,044), что свидетельствует о возможной роли VEGF в патогенезе СНМ. По данным последних исследований, в которых оценивали ангиографическую картину, у пациентов с миопической СНМ выявлялись существенная задержка хориоидальной фазы и уменьшение хориокапиллярного слоя, что приводит к гипоксии и ишемии, которые являются мощным стимулятором для выработки VEGF [45].
В качестве анти-VEGF-препаратов используют Pegaptanib (Macugen, «Eyetech Pharmaceuticals»), ранибизумаб (Lucentis, «Novartis Pharmaceuticals Corporation») и off-label бевацизумаб — препарат, первоначально разработанный для лечения метастатического рака толстой и прямой кишки (авастин, «Genentech») [46, 47].
В одних исследованиях применяли инъекцию 1 мг бевацизумаба в стекловидное тело, другие исследователи предлагают вводить 1,25 мг, основываясь на том, что в эксперименте на кроликах введение 2,5 мг не является токсичным для сетчатки [48, 49]. Тем не менее из-за большого размера глаза «внутриглазной обмен» бевацизумаба замедляется, что может вызвать негативное влияние на собственные сосуды сетчатки, РПЭ и хориокапилляры [50].
Наиболее современным и распространенным методом лечения миопической СНМ является эндовитреальное введение ранибизумаба. По данным L. Hefner [51], для купирования активности новообразованных сосудов требуется в среднем 3 инъекции (диапазон 1—8) в течение 39,6 мес (диапазон 31—52). Перед первой инъекцией острота зрения составляла (LogMAR) 0,69±0,26, через 1 мес она улучшилась до 0,39±0,23 (р=0,002), через 3 мес — до 0,30±0,22 (р=0,002), 6 мес — до 0,30±0,22 (р=0,002). Через 1 год острота зрения была 0,30±0,22 (р=0,001), через 2 года — 0,30±0,24 SD (р=0,001). У 11 из 15 пациентов острота зрения оставалась стабильно высокой на протяжении 36 мес.
В международном мультицентровом исследовании REPAIR зарегистрирована высокая эффективность эндовитреального введения ранибизумаба при миопической СНМ. Через 6 мес после начала лечения средняя острота зрения увеличивалась на 12,2 букв при уменьшении толщины сетчатки в макулярной зоне на 108 мкм. Пациенты получали в среднем 1,9 инъекции за этот период [52].
По данным 4-летнего наблюдения 92 пациентов с миопией высокой степени и СНМ (средний возраст 57 лет, SD 14, диапазон 30—93), эндовитреальное введение ранибизумаба существенно улучшило остроту зрения. Среднее количество букв до лечения составляло 46,1 (SD 16,8, диапазон 5—70), через 12 мес — 55,5 (SD 18,6, диапазон 10—85), через 24 мес — 50,1 (SD 20,1, диапазон 5—82), через 36 мес — 54,2 (SD 21,9, диапазон 2— 85) и через 48 мес — 53,1 (SD 22,5, диапазон 1—83) (р=0,000). Среднее общее количество инъекций составило 4,9 за период наблюдения [53].
В мире активно ведутся поиски причин, влияющих на терапевтическую эффективность антиангиогенной терапии.
В Японии в результате обследования 357 пациентов с миопией (ПЗО 26,0 мм) и 83 пациентов, получавших анти-VEGF-терапию по поводу миопической СНМ, было доказано влияние полиморфизма rs2010963 гена VEGF на развитие терапевтического ответа [54]. Однако данный полиморфизм не связан с рецидивированием и прогрессированием СНМ.
Несомненно, что исходные функциональные и морфологические данные влияют на исход заболевания [55].
В большинстве исследований серьезных системных побочных эффектов у пациентов с миопией после эндовитреального введения как бевацизумаба, так и ранибизумаба выявлено не было. Наиболее частыми глазными осложнениями признаны: прогрессирование помутнения хрусталика и развитие катаракты, фовеошизис, «целлофановая макула» —прогрессирование эпиретинального фиброза, единичные случаи развития макулярного отверстия и отслойки сетчатки [56].
Разрывы РПЭ и отслойка сетчатки были зарегистрированы в результате сократительной силы развившейся в процессе регресса неоваскулярной мембраны после интравитреальных анти-VEGF-инъекций. Японскими исследователями описан случай отслойки сетчатки, развившейся через 1 мес после введения ранибизумаба у пациента с миопической макулопатией, СНМ и макулярным отверстием. Наиболее часто встречающимся осложнением при эндовитреальных инъекциях признано повышение внутриглазного давления [57—61].
Здравоохранение, социальные службы и страховые компании сегодня проявляют повышенный интерес к проблеме профилактики прогрессирования и лечению миопической макулопатии. В то же время для разработки адекватных профилактических программ необходимо понимание причинно-следственных связей, обусловливающих данный процесс. На сегодняшний день накоплен большой клинический опыт по изучению различных форм миопической макулопатии. Однако остаются вопросы по причинам прогрессирования заболевания, перехода в различные формы или стадии либо их сочетание. В связи с развитием новых технологий появилась возможность прижизненного детального изучения как склеральной, так и сосудистой оболочки миопического глаза. С увеличением числа проводимых интравитреальных инъекций повышается количество осложнений данной терапии. В связи с этим требуется систематизировать подход к отбору пациентов, проведению инъекций и ведению пациентов после терапии.