Миорелаксанты что это такое в медицине и для чего он предназначен
Место миорелаксантов в лечении болевого синдрома
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Болевой синдром – один из основных компонентов защитной системы организма. Боль – важнейший сигнал о повреждении ткани и развитии патологического процесса. Многие острые и хронические заболевания, медицинские вмешательства и травмы сопряжены с болью, требующей применения анальгетических средств [1].
Ощущение боли формирует целый комплекс защитных реакций, направленных на устранение повреждения [2]. Острая (преходящая) боль обусловлена острым заболеванием, травмой и прекращается по мере выздоровления и заживления ран. Хроническая (персистирующая) боль связана с длительно существующим патологическим процессом или посттравматическим состоянием, продолжается от 1–3 мес. до многих лет [3]. Хроническая боль – это больше, чем физический симптом. Ее постоянное присутствие имеет множество проявлений, включая поглощенность пациента болью, ограничение личной, социальной и профессиональной деятельности, аффективные расстройства, использование большего количества медикаментов и частое обращение за медицинской помощью, когда в целом человек сживается с «ролью больного» [4, 5].
В клинической и амбулаторной практике при болевом синдроме чаще всего используют нестероидные противовоспалительные препараты (НПВП), обладающие обезболивающим действием, которое сочетается с противовоспалительным и жаропонижающим эффектом. Анальгетическое действие данных средств, так же как и всех НПВП, обусловлено подавлением активности циклооксигеназы (ЦОГ) и снижением продукции простагландинов E2 и F2, повышающих чувствительность ноцицепторов как при воспалении, так и при повреждении тканей. Более выраженным анальгетическим, чем противовоспалительным эффектом обладают те НПВП, которые вследствие своей химической структуры нейтральны, меньше накапливаются в воспалительной ткани, быстрее проникают через гематоэнцефалический барьер и подавляют ЦОГ в ЦНС, а также влияют на таламические центры болевой чувствительности [6, 7].
В мировой медицинской литературе представлено огромное количество данных о побочных эффектах терапии НПВП. У 30–40% больных, получающих НПВП, отмечаются диспептические расстройства, у 10–20% – эрозии и язвы желудка, двенадцатиперстной, тонкой, а иногда и толстой кишки, у 2–5% – кровотечения и перфорации. Причем гастро- и энтеротоксичность могут иметь место при любом пути введения НПВП. Также отмечают нефро-, гепато- и гемотоксичность некоторых НПВП [6–9].
Снизить вероятность развития и выраженность проявления нежелательных лекарственных реакций при назначении НПВП, а также повысить эффективность проводимой терапии возможно при комбинированном подходе к лечению болевого синдрома. Это позволяет сократить дозы противовоспалительных препаратов и сроки их назначения [6–9].
В патогенезе болей различной локализации (мышечно-тонические боли в спине вследствие остеохондроза или спондилоартроза, миофасциальный синдром, головная боль напряжения (ГБН) и др.) часто можно отметить мышечно-спастический компонент. Боль, обусловленная мышечно-тоническим и/или миофасциальным болевым синдромом, очень часто является основной причиной обращения пациента к врачу. Нередко болевые синдромы становятся причиной ограничения и даже утраты трудоспособности. В этой связи важно заметить, что при адекватной и своевременной терапии болевой синдром может довольно быстро купироваться. Врачебная тактика при лечении подобных пациентов заключается, с одной стороны, в ослаблении боли и в стремлении к как можно более быстрому возвращению пациента к активному образу жизни и, с другой стороны, в предупреждении повторных обострений и хронического течения болевого синдрома [7, 10–13].
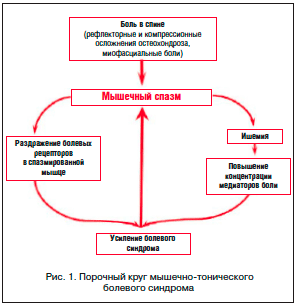
Применение миорелаксантов обосновано признанием важной роли мышечного спазма в патогенезе боли в нижней части спины. Доказано, что при острой поясничной боли добавление к стандартной терапии (НПВП) миорелаксантов приводит к более быстрому регрессу боли, мышечного напряжения и улучшению подвижности позвоночника. Боль различного генеза (вследствие поражения межпозвонковых дисков, фасеточных суставов позвоночника, самих мышц и других причин) повышает активность двигательных нейронов спинного мозга, что приводит к мышечному спазму, который, в свою очередь, играет значительную роль в поддержании самой боли. Патогенез возникновения хронических болевых мышечно-тонических синдромов обусловлен механизмом порочного круга: боль и напряжение мышцы – перевозбуждение спинальных нейронов (вставочных и мотонейронов) – напряжение мышц и изменение позы – еще большее усиление боли. При этом ухудшается кровоснабжение мышц, повышается концентрация медиаторов боли, раздражаются болевые рецепторы в спазмированной мышце. Миорелаксанты разрывают порочный круг «боль → мышечный спазм → боль» и вследствие этого способны ускорять процесс выздоровления (рис. 1) [10, 11, 14].
Большое значение в патогенезе болевых мышечно-тонических синдромов имеют вставочные спинальные нейроны. Их состояние определяется влиянием нисходящих супраспинальных путей, среди которых особое место принадлежит структурам среднего и продолговатого мозга. Регуляция проведения ноцицептивных стимулов на спинальном уровне осуществляется при участии супраспинальных адренергических структур. Ингибирующее действие тормозящих спинальных нейронов реализуется с участием различных нейромедиаторных систем (глутаматергической, ГАМК-ергической*, адренергической и др.). Именно с этими структурами связано действие большинства миорелаксирующих препаратов. Наиболее важные положительные эффекты миорелаксантов: уменьшение боли, снижение болезненного мышечного напряжения, улучшение двигательной активности, уменьшение дозы обезболивающих препаратов, в т. ч. НПВП. Лечение миорелаксантами начинают с обычной терапевтической дозы и продолжают при наличии болевого синдрома; как правило, курс лечения составляет несколько недель. Для лечения острых болей в нижней части спины в качестве эффективных миорелаксантов применяются тизанидин, дантролен, диазепам, баклофен, толперизон и др. [7, 10, 14].
Эффективным препаратом для лечения миофасциальных болевых синдромов, мышечно-тонических синдромов и спастичности различного генеза является релаксант скелетной мускулатуры центрального действия, агонист α2-адренергических рецепторов тизанидин (Сирдалуд, «Новартис Фарма АГ», Швейцария). В основе патогенетического действия препарата лежит комплексный механизм: сочетание миорелаксантного, уменьшающего болевой поток из перикраниальных мышц, и центрального умеренно выраженного анальгезирующего эффекта.
По механизму своего действия и особенностям применения он выгодно отличается от других миорелаксантов, поскольку обладает и миорелаксирующим, и анальгезирующим действием. Обезболивающий эффект препарата при болевых мышечно-тонических синдромах обусловлен как расслаблением патологически напряженных мышц, так и непосредственным антиноцицептивным действием, которое реализуется на спинальном и супраспинальном уровнях и связано с адренергической активностью препарата. Тизанидин, угнетая стимуляцию NMDA-рецепторов, блокирует механизм, отвечающий за избыточный мышечный тонус; подавляя полисинаптические рефлексы на уровне спинного мозга, угнетает высвобождение возбуждающих аминокислот и активирует глицин, снижающий возбудимость интернейронов спинного мозга. В результате снижается мышечный тонус. Тизанидин обладает и непосредственным, не связанным со снижением мышечного тонуса, обезболивающим действием. Миорелаксирующий и анальгетический эффекты тизанидина (Сирдалуда) носят дозозависимый характер. При приеме внутрь максимальная концентрация Сирдалуда в крови достигается через 1 ч. Прием пищи не влияет на его фармакокинетику. Начальная доза препарата варьирует от минимальной – 2 мг на ночь до 6 мг/сут в 3 приема. Средняя терапевтическая доза – 12–24 мг/сут. Максимальная доза – 36 мг/сут. Использование Сирдалуда наиболее эффективно в острую фазу заболевания. Положительный эффект (уменьшение выраженности мышечного спазма, боли в покое, при движении, ночью) отмечается уже на 3-й день терапии. Оптимальная доза Сирдалуда – 8–12 мг/сут (2–4 мг утром, 2–4 мг днем и 4 мг вечером). Подбор индивидуально эффективной дозы (от 2 мг до максимальной дозы 24–36 мг/сут) обычно осуществляется в течение 2–4 нед. [10, 15–17].
Эффективность и безопасность Сирдалуда при лечении острых болей в спине были убедительно доказаны почти 20 лет назад в плацебо-контролируемом исследовании. Применение тизанидина по 4 мг 3 р./сут в течение 7 дней при острой боли в нижней части спины имело достоверное преимущество над плацебо в отношении снижения боли в покое, болевых ощущений в ночное время, увеличения двигательной активности. В исследовании, проведенном D. Hutchinson (1990), осложнения со стороны ЖКТ отмечались у 6% больных, получавших по поводу боли в спине Сирдалуд и ибупрофен, и у 20% – комбинацию плацебо и ибупрофена. Важно отметить, что тизанидин (Сирдалуд) усиливает обезболивающее и противовоспалительное действие НПВП (нимесулида, диклофенака, мелоксикама и др.), позволяет снизить их дозу и, обладая гастропротекторной эффективностью, снижает риск возникновения гастропатий, обусловленных НПВП [7, 10, 18].
В настоящее время Сирдалуд представляет собой один из наиболее широко используемых миорелаксантов при лечении болей различной локализации, его эффективность и безопасность подтверждаются в современных исследованиях. Даже при выраженных и трудно поддающихся лечению болевых синдромах удается достигнуть улучшения. Антиспастический эффект тизанидина (Сирдалуда), связанный с несколькими механизмами действия (пресинаптическое и постсинаптическое ингибирование вставочных нейронов, возможное влияние на глутаматергическую систему), делает возможным его использование при патофизиологически различных заболеваниях, приводящих к спастике, в т. ч. при рассеянном склерозе, хронической миелопатии и спастичности после инсульта. Уменьшая выраженность спастики, Сирдалуд не снижает мышечную силу. Выраженные анальгетические свойства α2-агонистов позволяют успешно использовать Сирдалуд в лечении хронических болевых состояний, включая болевые спазмы, миофасциальную боль, нейропатическую боль и хроническую ежедневную головную боль, в т. ч. цервикогенные головные боли, связанные с мышечным спазмом.
Сирдалуд успешно используется в реабилитационной практике. Отмечаются снижение повышенного мышечного тонуса, нарастание объема пассивных движений в суставах, уменьшение выраженности контрактур, реже возникают клонусы. Препарат эффективен при спастичности как спинального, так и церебрального генеза, что подтверждается клиническими данными [10, 17–26].
Одним из показаний для назначения Сирдалуда является ГБН – самый часто встречающийся вид головной боли (45–80% среди ее других типов). Она представляет собой особый вид реакции на эмоциональный стресс и развивается в результате непроизвольного напряжения перикраниальных мышц или психического напряжения. В работе Е.Г. Филатовой и соавт. (1997) было показано уменьшение головной боли в 75% случаев у пациентов с ГБН при применении тизанидина в суточной дозе 4–6 мг в течение 14 дней. Об эффективности тизанидина (Сирдалуда) при ГБН свидетельствуют уменьшение выраженности головной боли, реактивной тревоги и депрессии, нормализация ночного сна, уменьшение выраженности вегетативных расстройств [15, 27, 28].
Монотерапия ГБН Сирдалудом может быть рекомендована больным с наличием напряжения перикраниальных мышц, мышц шеи и верхнего плечевого пояса при средней выраженности депрессивных эмоциональных нарушений. Двойное слепое плацебо-контролируемое исследование, проведенное R. Fogelhom, K. Murros et al. (1992), показало, что лечение тизанидином (Сирдалудом) в дозе 6–18 мг/сут на протяжении 6 нед. достоверно снижало интенсивность хронической ГБН. Меньшие дозы Сирдалуда (3 мг/сут, разделенные на 3 приема), по данным японских исследователей, также дают хороший эффект: значительное уменьшение интенсивности, частоты и продолжительности хронической ГБН в ходе 4-недельного курса лечения отмечено у 2/3 больных. Лечение рекомендуется начинать с малых доз: 2 мг/сут (на ночь) в течение первых 3-х дней, затем постепенно повысить дозу до 2 мг 2 р./сут (утром и на ночь). При недостаточном эффекте доза может быть повышена до 6–8 мг/сут (по 2 мг 3 р./сут или по 2 мг утром и днем и 4 мг на ночь). Продолжительность лечения может составлять от 2 нед. до 2 мес. [15, 28–30].
Нарушения мышечного тонуса, связанные с ними болевые синдромы, ограничения двигательных функций, вторичные изменения суставов и мышц составляют часть клинических проявлений многих заболеваний нервной системы. Как правило, клиническое значение приобретает проблема повышения мышечного тонуса. Наиболее широко применяется тизанидин (Сирдалуд) в лечении спастичности при травматических повреждениях головного и спинного мозга, рассеянном склерозе, инсульте. При спастичности, связанной с дистоническими нарушениями, паркинсонизмом, более целесообразно использование других средств (например, клоназепама, диазепама). Достаточно широкий диапазон эффективно действующих доз тизанидина (Сирдалуда) (от 2 до 36 мг/сут) позволяет использовать препарат для коротких и длительных курсов лечения болевых синдромов и спастичности в виде монотерапии или в сочетании с другими лекарственными средствами [15, 31–33].
Побочные эффекты на фоне приема Сирдалуда минимальны и чаще заключаются в легкой преходящей сонливости, сухости во рту, диспепсии и общей слабости. Тизанидин (Сирдалуд) оказывает анксиолитическое и седативное действие. Седативный эффект полезен больным с болевыми синдромами и сопутствующими нарушениями сна. В случае, когда седативный эффект нежелателен, его можно контролировать путем титрации дозы. Могут отмечаться артериальная гипотония, брадикардия. При приеме более высоких доз вышеперечисленные побочные действия возникают чаще и более выражены, однако они редко бывают настолько тяжелыми, чтобы лечение пришлось прервать. Частота возникновения побочных реакций коррелирует с уровнем препарата в плазме крови и достигает пика в течение 1 ч после приема [15, 26, 34].
Заключение
Благодаря высокой эффективности и благоприятному спектру побочных эффектов Сирдалуд рассматривается как препарат первой очереди выбора для лечения острой и подострой миофасциальной боли в монотерапии, а также хронического миофасциального синдрома в комбинации с другими медикаментами, чаще антидепрессантами.
Сирдалуд отличается от других миорелаксантов, поскольку обладает и миорелаксирующим, и анальгезирующим действием. Важным свойством тизанидина (Сирдалуда) является способность предохранять повреждение слизистой желудка при приеме НПВП. Назначение Сирдалуда в комплексной терапии болевого синдрома способствует уменьшению не только доз НПВП, но и проявлений ульцерогенного действия противовоспалительных препаратов за счет доказанного гастропротективного эффекта.
Обезболивающий эффект препарата при болевых мышечно-тонических синдромах обусловлен как расслаблением патологически напряженных мышц, так и непосредственным антиноцицептивным действием, которое реализуется на спинальном и супраспинальном уровнях и связано с адренергической активностью препарата. Стоит подчеркнуть, что снижение мышечного тонуса на фоне назначения Сирдалуда не сопровождается уменьшением мышечной силы, и это особенно важно для пациентов с центральными парезами (рассеянный склероз, остаточные явления перенесенного инсульта и т. д.). Сирдалуд, являясь агонистом α2-адренергических рецепторов, угнетает полисинаптические спинальные рефлексы и практически не влияет на моносинаптические рефлексы. Поэтому на фоне действия Сирдалуда уменьшается лишь тонический компонент мышечного сокращения при сохранности фазической реакции. Это отлично от действия других миорелаксантов (особенно баклофена), уменьшающих тонический и фазический компоненты, что сопровождается нежелательным снижением силы мышц.
* ГАМК – γ-аминомасляная кислота.
Только для зарегистрированных пользователей
Миорелаксанты центрального действия в лечении миофасциальной боли
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Миофасциальная боль представляет собой весьма частое событие в клинической практике, достигая, по некоторым оценкам, 30% от общего числа обращений [1]. Миофасциальная боль является одной из основных причин болей в спине [2], распространенность которых превышает 50% в популяции и резко возрастает в пожилом возрасте. По данным Л.А. Богачевой (1996, 1998), при исследовании 4 тыс. пациентов с болевым синдромом в мышцах спины лишь у 5% выявлялись радикулопатии и туннельные невропатии, в то время как мышечно-скелетная дисфункция наблюдалась у 95% обследованных больных [3].
Патофизиология мышечной боли довольно сложна, а отдельные механизмы имеют противоречивую трактовку исследователями. Однако неоспоримой остается значимость мышечного спазма в развитии болевого синдрома. Локальные мышечные боли возникают при активации тонких миелиновых Aδ и немиелинизированных С-волокон. Эта активация может быть индуцирована тепловым или механическим раздражителем, местным воспалением или ишемией. Предлагаются различные теоретические модели развития миогенной боли [4]. Первая модель связана с изменениями в дорсальном роге, ведущими к формированию патологических межнейрональных синапсов. Результатом этого является появление первичных неболевых стимулов, которые интерпретируются как болевые в связи с патологической сенситизацией ноцицептивных нейронов и вовлечением вторичных нейронов. Вторая модель развития боли связывает возникновение миогенной боли с нарушением активации нисходящих ингибиторных путей, которые в норме подавляют афферентную стимуляцию. Третья связывает постоянную периферическую сенситизацию ноцицептивных периферических волокон с повторными микротравмами или хронической локальной ишемией. Локальная ишемия возникает в результате как вазоконстрикции, так и нейрогенного отека, нарушающего микроциркуляцию. Влияние центральных механизмов при депрессивных нарушениях на модулирование болевой афферентации также активно обсуждается [5].
Признано, что основной клинический элемент миофасциального синдрома – триггерная точка, с которой связано появление плотного пальпируемого мышечного тяжа [6]. Именно она создает почву для развития и поддержания болевых ощущений. Считается, что постоянное мышечное напряжение индуцируется усиленным высвобождением ацетилхолина и приводит к развитию локальной ишемии и последующей сенситизации ноцицептивных нервных волокон [7]. Согласованность между различными специалистами при постановке диагноза миофасциального синдрома на основе наличия триггерных точек считается достаточной для придания этому состоянию статуса отдельной нозологической формы [8].
Клиническая картина миофасциальных болей довольно сильно варьирует, часто сложно провести границу между миофасциальным синдромом и фибромиалгией. Вместе с тем, не касаясь подробнo вопроса постановки диагноза, следует указать, что для выявления триггерных точек, являющихся основным признаком миофасциального синдрома, существуют критерии, разработанные D. Simmons, J. Travell [6]. При этом локализация болевого синдрома может быть весьма разнообразна и не ограничиваться мышцами спины и лицевого черепа.
Для лечения миофасциальных болей широко используют методы мануальной терапии, физиотерапию, лечебную физкультуру, инъекции анестетика в триггерные точки. Очевидно, что немедикаментозная терапия занимает ведущее место в терапии подобных синдромов, однако современные лекарственные средства также обладают высоким терапевтическим потенциалом в отношении купирования боли при миофасциальном синдроме при относительно невысоких рисках развития нежелательных явлений. При этом основной класс препаратов, обоснованно используемых для лечения миофасциальной боли, – миорелаксанты центрального действия.
Важно, что эффективность препаратов, обладающих центральным миорелаксантным действием при болевом синдроме, обусловленном воспалительным процессом, в частности ревматоидным артритом, не доказана [9]. В Кохрановском обзоре 2012 г. не получено данных, подтверждающих превосходство миорелаксантов, как принадлежащих к группе бензодиазепинов, так и не принадлежащих к ней, над плацебо. При этом обращает на себя внимание достаточно высокая частота развития нежелательных явлений: NNTH1 при сравнении с плацебо достигает значения 3 [95%, ДИ 2–7].
Перечень лекарственных средств, относящихся к классу миорелаксантов, достаточно широк. Остановимся на отличительных особенностях некоторых из них. Следует сказать, что большая часть собственно миорелаксантов центрального действия не представлена на рынке РФ. В таблице 1 указаны препараты по анатомо-терапевтическо-химической классификации (АТХ)2, относящиеся к миорелаксантам центрального действия.
Клинически значимое миорелаксирующее действие свойственно препаратам из группы бензодиазепинов (диазепам, лоразепам, клоназепам) в связи с тем, что эти препараты с клинической точки зрения также рассматривают, как миорелаксанты центрального действия, несмотря на выраженный седативный эффект. Они широко представлены на рынке РФ. Таким образом, имеет смысл коротко остановиться на наиболее важных представителях класса центральных миорелаксантов, таких как баклофен, тизанидин, толперизон и бензодиазепины.
Важно, что миофасциальный синдром или его терминологические эквиваленты, подчеркивающие важность функциональных нарушений в развитии этого синдрома, а не органической патологии, присутствуют в разделе «показания» инструкций по применению только для тизанидина, толперизона и бензодиазепинов. Для препаратов баклофена показанием являются состояния, связанные с повышением мышечного тонуса, точнее спазма, только при органических повреждениях спинного и головного мозга. Данные научных исследований подтверждают эффективность баклофена при миофасциальном синдроме [4], однако его применение в этом случае происходит в определенном смысле «off-label». Структурно баклофен относится к агонистам GABA-В рецепторов, в результате стимуляции которых происходит уменьшение выделения возбуждающих нейротрансмиттеров (субстанция Р) и аминокислот (глутамата и аспартата) из терминалей. Баклофен принимается внутрь или вводится интратекально, однако для обеих лекарственных форм этого препарата миофасциальный синдром не является показанием для назначения.
Для бензодиазепинов (диазепам, лоразепам, клоназепам и др.) применение при болевом синдроме, обусловленном функциональными нарушениями мышечного тонуса с появлением мышечного спазма, достаточно обоснованно, и это показание регламентируется в инструкциях для препаратов этой группы. Однако их выраженный седативный эффект требует постоянной оценки степени его реализации в сравнении с миорелаксирующей и обезболивающей активностью. В этой связи довольно продолжительный период полувыведения у бензодиазепинов, превышающий 10 ч, отрицательно влияет на возможность широкого применения этой группы препаратов при миофасциальном синдроме. То есть после приема бензодиазепинов терапевтические концентрации, существенно влияющие на концентрационные способности, сохраняются продолжительное время. Таким образом, остается 2 лекарственных средства, наиболее часто применяемых в России для лечения миофасциального синдрома и близких к нему состояний.
Толперизон применяется в медицинской практике с 1960-х гг. в странах Восточной Европы. В 2011 г. по инициативе Немецкой контрольно-разрешительной системы комитет Европейского агентства по лекарственным препаратам (ЕМА), применяемым в медицине (CHMP – Committee for Medicinal Products for Human Use), начал пересмотр оценки отношения ожидаемой пользы к риску применения препаратов толперизона по различным показаниям. Результат работы был представлен в виде документа ЕМА, датированного 21.01.2013 г. [10]. В документе представлена следующая информация. Большинство исследований применения пероральных форм толперизона выполнены в 1960–1970-х гг. и не соответствуют современным представлениям о проведении клинических испытаний. Имеющиеся данные, обосновывающие применение препарата при заболеваниях опорно-двигательного аппарата, сосудистых поражениях, реабилитации после хирургических вмешательств и детском церебральном параличе, крайне ограниченны и неубедительны. Только применение толперизона у больных со спастическим синдромом после инсульта позволяет констатировать эффективность этого лекарственного средства. Эффективность толперизона в сравнении с плацебо составила 32% против 14% соответственно. В то же время большое число спонтанных сообщений о частоте побочных реакций (половина из которых – реакции повышенной чувствительности) не соответствует результатам клинических исследований. На основании этих данных CHMP делает заключение о том, что для толперизона благоприятным отношение ожидаемой пользы к возможным рискам применения может считаться только при использовании его для лечения спастического синдрома у больных после перенесенного инсульта [10].
Надо заметить, что опубликованные исследования эффективности толперизона при лечении миофасциальной боли, не связанной с постинсультными изменениями, обосновывают его применение. В частности, это касается работы H.G. Pratzel, проведенной в 1996 г. в Мюнхенском институте бальнеологии и климатологии (Германия) [11]. В исследовании, имевшем дизайн параллельного двойного слепого плацебо-контролированного, показано превосходство толперизона над плацебо. Терапия продолжалась на протяжении 21 дня у 138 больных. Очевидно, что регуляторным органом ЕС (ЕМА) могла быть получена более подробная информация, которая позволила прийти к обозначенному выше решению.
Последний из этой группы лекарственных средств – тизанидин с 1992 г. присутствует на рынке РФ в виде оригинального препарата Сирдалуд («Новартис Фарма»). Тизанидин реализует свой эффект на спинальном и супраспинальном уровнях. Стимулируя пресинаптические α2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют NMDA-рецепторы. Это приводит к угнетению полисинаптических рефлексов спинного мозга, ответственных за гипертонус мышц, и подавлению передачи возбуждения через них, что вызывает снижение повышенного тонуса сгибательной и разгибательной мускулатуры и уменьшение болезненных мышечных спазмов. В дополнение к миорелаксирующим свойствам тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект (за счет снижения высвобождения возбуждающих нейромедиаторов в головном мозге на уровне locus cоeruleus). В исследованиях на животных было показано, что тизанидин может реализовывать свой эффект через снижение центральной сенситизации. Период полувыведения препарата из системного кровотока составляет 2–4 ч.
Исследования эффективности препарата при мышечной боли проводились в основном в 1990-х гг. В исследовании J. Mojica была изучена эффективность тизанидина при миофасциальном синдроме в области шеи и плечевого пояса [12]. Отмечалось достоверное снижение интенсивности боли к 3-му дню лечения при приеме 2 мг 3 р./сут. В международном клиническом исследовании эффективности тизанидина для лечения мышечного болевого синдрома у больных в поликлинической практике участвовало более 2 тыс. больных, эффективность терапии достигала 89% [13]. Исследование, в котором участвовали 29 женщин с миофасциальным синдромом хронического, торпидного течения, было проведено в США. Пациентки получали терапию различными препаратами, включая НПВП, однако их эффективность не достигала желаемого уровня. Продолжительность болевого синдрома колебалась от 9 до 52 нед. Суточная доза тизанидина у части больных повышалась до 12 мг на протяжении 3-х нед. и сохранялась стабильной на протяжении 2-х нед. Интенсивность боли с клинической точки зрения существенно снижалась к 3 нед. терапии. Достоверно улучшались и функциональные показатели, и порог болевых ощущений, определяемый альгометром [14].
Вопрос безопасности миорелаксантов при использовании для лечения миофасциального синдрома достаточно важен, учитывая, что существенного различия в их эффективности по результатам крупных метаанализов найти не удается [15]. Вопрос безопасности терапии тизанидином достаточно хорошо изучен. Определенно можно сказать, что препарат обладает одним из лучших профилей безопасности, принципиального отличия спектра нежелательных явлений препарата от нежелательных явлений при применении иных миорелаксантов не отмечено. Вместе с тем пострегистрационное применение препарата позволило выявить возможное нежелательное явление, связанное с возможным удлинением интервала QT. Особое внимание к этому вопросу привело к тому, что в 2013 г. был начат набор больных в новое исследование безопасности тизанидина, связанное с оценкой влияния этого лекарственного средства на характеристику реполяризации миокарда [16]. В исследовании планируется участие 116 здоровых добровольцев, которые на протяжении 14 дней будут получать 24 мг тизанидина ежедневно. К окончанию терапии будет оцениваться ЭКГ, в частности интервал QT. Это исследование даст принципиально важную информацию относительно группы состояний, при которых не следует использовать тизанидин или необходимо соблюдать осторожность при его приеме. Завершение исследования планируется к середине 2014 г.
Таким образом, выбор миорелаксантов для лечения миофасциальной боли является довольно ограниченным. Решающим в данном случае будет вопрос безопасности и переносимости препаратов. Этим требованиям полностью соответствует Сирдалуд.
Оптимальный выбор препарата из этой группы лекарственных средств врач должен делать с учетом индивидуальных особенностей больного, т.к. отношение ожидаемой пользы к возможным рискам нежелательных явлений очень варьирует для каждого пациента с миофасциальной болью.
1 NNTH – Number Needed to Treat, Harm: число больных, которых нужно лечить определенным методом в течение определенного времени для выявления дополнительного неблагоприятного исхода
2 Анатомо-терапевтическо-химическая классификация (англ. Anatomical Therapeutic Chemical Classification System) – международная система классификации лекарственных средств. Наиболее распространенная и употребляемая в документах Минздрава России аббревиатура АТХ.