Передозировка сонапаксом к чему приведет
Препараты для вывода из запоя
Наша наркологическая клиника с 2011 года успешно лечит алкоголизм и наркоманию. Работаем официально по лицензии № ЛО-77-01-020532. В штате наркологи с опытом работы от 10 лет, включая врачей высшей квалификационной категории.
Клиника располагает большим комфортабельным стационаром. Врачебные бригады выезжают на дом к пациентам по Москве и области. Позвоните сейчас, чтобы получить рекомендации врача и узнать актуальную цену медицинских услуг.
Работаем круглосуточно. 100% анонимно. Обязательно поможем!
Очень часто случается так, что праздники, застолья, дружеские посиделки заканчиваются так, как не хотелось бы. Заведено, что на праздники, выходные, при походе в ресторан или встречах дома, люди выпивают и количество выпитого спиртного, как обычно, не замечается. В результате, следующее утро становится не совсем «добрым» и сопровождается разной тяжести.
По этой причине вопрос, как быстро вывести алкоголь из организма, является весьма распространенным.
Естественно, что удалить алкоголь из крови сразу практически невозможно и, порой, опасно без применения специализированной врачебной наркологической помощи. Однако возможно снизить вредное влияние этанола на организм и устранить похмельный синдром. Для этого можно либо заняться самолечением, что не рекомендуется, либо вызвать специалиста для оказания квалифицированной помощи по выводу из запоя, лечению похмелья и даже просто для снятия интоксикации, и нормализации общего состояния.
Методы выведения алкоголя из крови
Однако, страдает от алкоголя не только лишь печень. Объем поражений организма и развивающихся заболеваний на фоне алкоголизма обширен: цирроз, гепатит, кардиомиопатия, гипертоническая болезнь, ишемическая болезнь сердца, панкреатит, энцефалопатия, развитие алкогольной эпилепсии, психические заболевания, развитие острого абстинентного синдрома.
Удаление алкоголя и продуктов его распада из крови трудное и долгое дело, если лечиться самостоятельно и быстро это сделать не представляется возможным по многим причинам. Скорость выведения зависит от общего состояния здоровья, состояния печени, генетической предрасположенности, пола и т.д. К примеру, у мужского населения скорость выведения этанола из организма составляет приблизительно одну десятую промилле/час, у женщин – девять сотых промилле/час.
В простой форме алкогольные вещества удаляются из организма посредством испарений через кожный покров, легкие и почки. Сделать быстрее вывод алкоголя можно прибегнув либо к народным средствам, что не рекомендуется, либо вызвать врача-нарколога для постановки капельниц с необходимыми препаратами.
Тиамин
Должен назначаться всем больным, которые обращаются к врачу по поводу алкогольной зависимости. Целью назначения тиамина является предупреждение развития энцефалопатии Гайе-Вернике и корсаковского синдрома. Отмечен положительный эффект при выводе из запоя.
β-адреноблокаторы
Назначаются для купирования вегетативной симптоматики при выведении из запоя. Обычно с этой целью применяют пропранолол или атенолол. Эти препараты не предупреждают развития судорог и делирия, поэтому их рекомендуется назначать в комбинации с другими средствами.
Клонидин
Бензодиазепины
Являются основным средством при выводе из запоя. Они уменьшают вероятность развития судорог и делирия, а при уже возникшем делирии сокращают его продолжительность. Длительно действующие бензодиазепины более эффективны в предупреждении эпилептических приступов, чем короткодействующие. Их недостатком является возможность кумуляции и избыточный седативный эффект. К данной группе препаратов относятся: Диазепам, Лоразепам, Оксазепам, Хлоразепат.
Карбамазепин
Эффективен в отношении всех симптомов при выведении из запоя и может быть препаратом выбора при прерывании запоев легкой и среднетяжелой степени. Отсутствие взаимодействия с алкоголем позволяет применять препарат даже при его наличии в крови. Установлено, что Карбамазепин влияет на нейрональную трансмиссию ГАМК, глутамата, норадреналина, ацетилхолина и дофамина. Монотерапия карбамазепином эффективна при легком и среднетяжелом синдроме отмены, при тяжелом течении рекомендуются бензодиазепины. Безусловным преимуществом карбамазепина является отсутствие эйфорического эффекта и риска зависимости от препарата.
Барбитураты
Являются весьма эффективным средством при выводе из запоя. Их применение ограничивает довольно высокая токсичность и риск развития зависимости. Как препарат длительного действия он может угнетать дыхание и сердечную деятельность; вызывает индукцию микросомальных ферментов печени.
Тиаприд
Является нейролептиком группы замещенных бензамидов и оказывает седативный эффект. Экстрапирамидные расстройства при его применении возникают редко, так как он селективно действует на D2-дофаминовые рецепторы. Препарат применяют в России, Германии и Франции для вывода из запоя. Целесообразно назначать тиаприд в сочетании с карбамазепином и бензодиазепинами.
Галоперидол
Пропротен-100
На сегодняшний день наиболее изученным из антительных препаратов является «Пропротен-100», содержащий потенцированные антитела к мозгоспецифическому белку S-100 (AS-100). Препарат Пропротен изучен на всех уровнях организации нейрональных структур: клеточном, межклеточном (синаптическом), структурном, системном. Наиболее специфическим из исследованных эффектов можно считать сенситизирующее влияние AS-100 на клеточную мембрану нейронов. Необычное биологическое действие на клиническом уровне проявляется сбалансированным воздействием на психический статус больных. В зависимости от исходного состояния пациентов, препарат оказывает как седативное, так и стимулирующее действие.
ГОМК (оксибутират натрия)
Препарат купирует вегетативную симптоматику и обладает довольно выраженным седативным эффектом, однако может увеличить вероятность развития галлюцинаций из-за непрямого стимулирующего действия на дофаминергические нейроны.
Клометиазол
Сенсибилизирующие средства
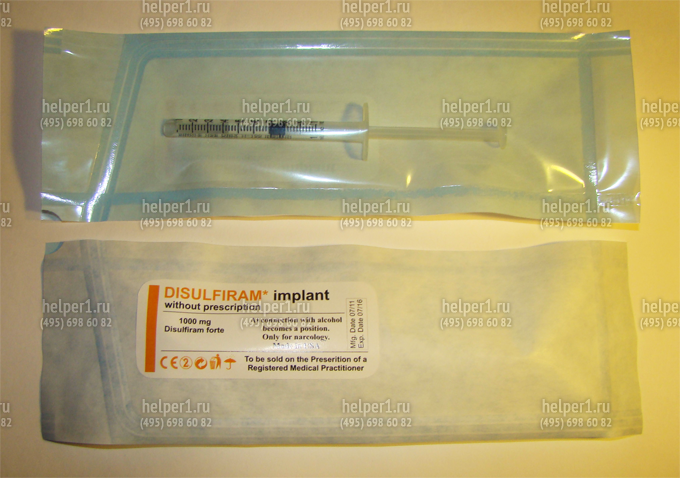
Используются при кодировании от алкоголизма для создания так называемого химического барьера, делающего невозможнымупотребление алкоголя, и выработки у пациента чувства страха перед возможными неприятными последствиями приема алкоголя. Наиболее распространенным сенсибилизирующим средством, применяемым в лечении алкогольной зависимости, является тетурам (антабус, дисульфирам). Широко назначавшиеся ранее сенсибилизирующие препараты метронидазол, фуразолидон, никотиновая кислота в настоящее время применяются редко. Дисульфирам (Disulfiram) используется для лечения алкогольной зависимости с 40-х годов прошлого века. Предполагается, что терапевтические эффекты тетурама обусловлены страхом перед тетурам-алкогольной реакцией (ТАР). Механизм действия этого препарата основан на блокировании фермента ацетальдегиддегидрогеназы, в результате чего окисление алкоголя задерживается на стадии ацетальдегида. Перед лечением тетурамом больной предупреждается о возможных неблагоприятных последствиях приема алкоголя.
Препарат Disulfiram для кодирования от алкогольной зависимости сроком действия до 1 года:
В настоящее время довольно распространенным методом лечения является внутримышечная имплантация препарата эспераль, который выпускают в запаянных ампулах, содержащих 10 таблеток по 0,1 г тетурама. Как правило, этот метод применяется при безуспешности других терапевтических мероприятий. Больному и его родственникам объясняют, что имплантированный в ткани препарат будет постоянно всасываться в кровь, и если больной выпьет даже небольшое количество алкоголя, у него возникнут тяжелые последствия вплоть до летального исхода.
Применение тетурама имеет много противопоказаний из-за выраженной токсичности препарата. На фоне его использования достаточно часто развиваются различные побочные эффекты в виде аллергических реакций, токсического гепатита, тетурамового психоза. Дисульфирам может обострять симптомы шизофрении. Необходимым условием лечения является хорошее состояние здоровья пациента, высокая мотивация, регулярность приема препарата. Следует особо отметить недопустимость назначения дисульфирама без ведома пациента (например, подсыпание в пищу) ввиду опасности последствий тетурам-алкогольной реакции.
Блокаторы опиоидных рецепторов
Успехи, достигнутые в изучении нейрохимических механизмов алкогольной зависимости, позволили предложить ряд новых медикаментов для ее лечения. Так, было установлено, что в головном мозге существует эндогенная опиоидная система, в которой вырабатываются морфиноподобные соединения (энкефалины и эндорфины), обусловливающие эйфорию и обезболивающие эффекты. Препараты, которые являются антагонистами опиоидов, блокируют опиоидные рецепторы и таким образом предотвращают приятные эффекты, вызванные приемом наркотиков. Несмотря на то что алкоголь не является агонистом олиоидных рецепторов, многие его эффекты реализуются посредством эндогенной опиоидной системы. Эксперименты показали, что антагонисты опиоидных рецепторов блокируют подкрепляющие эффекты алкоголя. Так, налтрексон предотвращал повышение уровня дофамина, вызванное введением алкоголя, причем этот эффект был дозозависимым. Как известно, дофамин вовлечен в подкрепляющие эффекты алкоголя. Длительность ремиссии у пациентов, принимавших в качестве поддерживающего лечения налтрексон, была больше по сравнению с пациентами, принимавшими плацебо. Следует иметь в виду, что налтрексон эффективен в качестве противорецидивного препарата при условии регулярного приема на протяжении 12-недельного курса. Особенно рекомендуется налтрексон пациентам с сильной, неконтролируемой тягой к алкоголю (компульсивное влечение). В то же время лечение препаратом предполагает высокую мотивированность. Эффективность лечения значительно повышается в сочетании с поддерживающей психотерапией. Препарат налмефен структурно схож с налтрексоном. В отличие от налтрексона, он не обладает гепатотоксичностью. Кроме того, налмефен является универсальным антагонистом опиоидных рецепторов, который блокирует три их типа.
Акампросат (ацетилгомотаурин). До настоящего времени точный механизм действия препарата не установлен. Известно, что он модулирует активность глутаматных и ГАМК-рецепторов. Хроническая алкогольная интоксикация приводит к снижению активности тормозной ГАМК-ергической системы и повышению активности возбуждающей глутаматной системы в головном мозге. Эти нарушения сохраняются длительное время после отказа от употребления алкоголя. Акампросат структурно схож с ГАМК и повышает активность ГАМК-ергической системы, увеличивая число мест связывания ГАМК на синоптической мембране. Акампросат снижает активность глутаматной системы, воздействуя на N-метил-D-аспартат (NMDA)-рецепторы и кальциевые каналы. Впервые в клинической практике акампросат начали применять во Франции в 1989 г. В настоящее время препарат разрешен более чем в 30 странах мира; общее число пациентов, прошедших курс лечения, превышает 1 млн. Эксперименты показали, что акампросат снижает потребление алкоголя в условиях свободного доступа, не влияя при этом на пищевое поведение, не имеет наркогенного потенциала и других фармакологических эффектов кроме тех, что способствуют снижению потребления алкоголя.
Серотонинергические агенты
Взаимосвязь между серотонином и алкоголем сложная. Предполагается, что алкоголики пытаются с помощью алкоголя нормализовать низкий базальный уровень серотонина в головном мозге. Было установлено, что серотонин участвует в подкрепляющих эффектах алкоголя. Кроме того, низкий уровень серотонина способствует импульсивному поведению, которое приводит к потреблению алкоголя. Абнормальность серотонинового обмена может сопровождаться тревогой и депрессией, и в этом случае алкоголь может употребляться в качестве средства самолечениия. К серотонинергическим средствам относятся ингибиторы обратного захвата серотонина (СИОЗС) сертралин (золофт), флюоксетин (прозак), флювоксамин (феварин), циталопрам. Этот класс препаратов был разработан в 80-х годах прошлого века для лечения депрессивных расстройств. Механизм действия СИОЗС заключается в блокировании обратного захвата серотонина пресинаптическими окончаниями, вследствие чего уровень серотонина в синоптической щели повышается.
Другие лекарственные препараты
Передозировка сонапаксом к чему приведет
Лекарственные экстрапирамидные расстройства часто встречаются в клинической практике и обычно связаны с лекарственными средствами, нарушающими баланс нейромедиаторов, главным образом изменяющими активность дофаминергических систем и функциональное состояние дофаминовых рецепторов. С применением лекарственных средств могут быть связаны различные экстрапирамидные синдромы: паркинсонизм, дистония, тремор, хорея, акатизия, тики, миоклония.
Лекарственный паркинсонизм обычно развивается вследствие приема нейролептиков (нейролептический паркинсонизм), особенно сильнодействующих блокаторов дофаминовых рецепторов с низкой холинолитической активностью (галоперидола, флуфеназина, трифтазина). Значительно реже паркинсонизм могут вызывать другие антагонисты (блокаторы) дофаминовых рецепторов (метоклопрамид, флунаризин), препараты, снижающие кругооборот дофамина в синапсах (альфа-метилдофа), снижающие чувствительность постсинаптической мембраны к дофамину (препараты лития), центральные симпатолитики, истощающие запасы дофамина в нервных терминалях (например, препараты раувольфии), серотонинергические средства (например, флуоксетин), тормозящие активность дофаминергических нейронов черной субстанции, особенно если их применяют в комбинации с нейролептиками.
Признаки нейролептического паркинсонизма чаще всего появляются через 2–12 нед. после начала лечения нейролептиком, резкого увеличения его дозы или отмены применявшегося ранее холинолитического корректора. Паркинсонизм чаще возникает у лиц старше 40 лет. У мужчин нейролептический паркинсонизм отмечается реже, чем у женщин. Особенностью нейролептического паркинсонизма является подострое развитие, симметричность проявлений, сочетание с лекарственными дискинезиями (дистонией или акатизией), эндокринными нарушениями (гиперпролактинемией), непрогрессирующее течение, отсутствие постуральной неустойчивости. Типичный тремор покоя (типа «скатывания пилюль») при лекарственном паркинсонизме отмечается редко, но зато часто встречается грубый генерализованный тремор, выявляющийся как в покое, так и при движении. Иногда встречается тремор, вовлекающий только периоральную область («синдром кролика»). В тяжелых случаях развиваются мутизм и дисфагия.
Помимо нейролептиков паркинсонизм могут вызывать близкие к ним препараты: метоклопрамид (Церукал), дипразин (Пипольфен), амоксапин, а также центральный симпатолитик резерпин, метилдофа, антагонисты кальция (циннаризин, флунаризин, дилтиазем, амлодипин). Описаны казуистические случаи возникновения паркинсонизма при приеме амиодарона, индометацина, циклоспорина, амфотерицина B, каптоприла, циметидина, клопамида, цитозин-арабинозида (цитарабина), диазепама, дисульфирама, альфа-интерферона, вальпроата натрия, дифенина, препаратов лития, трициклических антидепрессантов, селективных ингибиторов обратного захвата серотонина, тразодона и др.
Лечение. После отмены препарата паркинсонизм регрессирует в течение 2–12 нед. (более медленно у пожилых). Если отменить нейролептики невозможно, то следует рассмотреть вопрос о снижении дозы препарата, вызвавшего паркинсонизм, либо о замене его другим, в меньшей степени вызывающим экстрапирамидные осложнения, например тиоридазином (Сонапаксом) или клозапином (Лепонексом). Одновременно следует назначить холинолитики на срок как минимум 2–3 мес. В течение этого времени у значительной части больных развивается толерантность к экстрапирамидному действию нейролептика, и поэтому можно попытаться постепенно отменить холинолитики. Если на фоне отмены холинолитика симптомы паркинсонизма вновь появляются, то следует продолжить прием холинолитика в течение длительного времени. Амантадин при лекарственном паркинсонизме оказывает менее постоянное действие, чем холинолитики. Препараты леводопы обычно не назначают, так как они могут вызвать ухудшение первичного заболевания, по поводу которого назначались нейролептики.
У части больных симптоматика асимметрична и выявляется тенденция к прогрессированию. В этих случаях, вероятно, лекарственные средства выявляют уже существовавший, но остававшийся латентным дегенеративный процесс в черной субстанции.
Острая дистония (острая дистоническая реакция) возникает у 5% больных в первые дни (иногда часы) после начала приема нейролептиков или метоклопрамида, обычно в средней терапевтической дозе. Если лечение начинают с малой или, наоборот, очень высокой дозы, дистония возникает реже. Нейролептики чаще вызывают дистонию у юношей и молодых мужчин, метоклопрамид – у лиц женского пола. Дистония обычно возникает в период падения концентрации нейролептика к концу действия очередной дозы и связана с усилением синтеза и высвобождения дофамина и/или повышением чувствительности дофаминовых рецепторов, которая развивается как реакция на блокаду рецепторов нейролептиком. Дистония может также появиться при резком повышении дозы нейролептика или внезапной отмене корректоров (холинолитиков).
Дистония обычно вовлекает мышцы головы и шеи, вызывая гримасничанье, тризм или открывание рта, высовывание языка, форсированное отведение глазных яблок (окулогирный криз), кривошею с поворотом или запрокидыванием головы назад, стридор. При вовлечении аксиальной туловищной мускулатуры развиваются опистотонус, поясничный гиперлордоз, торсионная установка таза. Конечности вовлекаются редко. При вовлечении мышц гортани возможны дыхательные нарушения. Генерализованная лекарственная дистония чаще встречается у детей.
Внезапность, драматичность и причудливость гиперкинеза часто ведут к ошибочному диагнозу истерии, столбняка или эпилепсии. Патогенез острой дистонии неизвестен; по-видимому, существует наследственная предрасположенность к развитию этого синдрома. Острая дистония имеет доброкачественный характер и самостоятельно регрессирует в течение нескольких часов после отмены препарата. Но в тяжелых случаях приходится прибегать к внутривенному введению диазепама (Реланиума), антигистаминных средств (димедрола, дифенгидрамина), кофеин-бензоата натрия, введению внутрь или внутримышечно холинолитиков: тригексифенидила (Циклодола), биперидена (Акинетона). В дальнейшем дозу нейролептика целесообразно снизить и дополнительно назначить холинолитик, как минимум на 4–6 нед. Дистония, возникшая при внезапной отмене нейролептика, обычно требует повторного назначения этого препарата. После уменьшения или полного регресса гиперкинеза отмену нейролептика следует проводить более постепенно.
Чтобы предупредить развитие паркинсонизма или острой дистонии, следует использовать нейролептики строго по показаниям, применять их в минимальных эффективных дозах, профилактически назначать в качестве корректора холинолитики, как минимум на 4–6 нед. (после этого вероятность этих экстрапирамидных осложнений снижается), и можно сделать попытку постепенно отменить холинолитики (особенно у пожилых пациентов, более чувствительных к их побочному действию).
Поздняя дистония возникает спустя несколько месяцев от начала лечения нейролептиками. Поздняя дистония – относительно редкий вариант поздней дискинезии (см. ниже), чаще встречающийся у лиц молодого возраста (средний возраст начала – 40 лет). При приеме стабильной дозы нейролептика признаки дистонии обычно появляются и нарастают постепенно. Дистония чаще проявляется в форме фокальной дистонии (спастической кривошеи, орофациальной дистонии, блефароспазма, спастической дисфонии), значительно реже она бывает сегментарной или генерализованной. В ряде случаев возникает туловищная дистония, в частности вызывающая боковой наклон туловища – синдром «Пизанской башни». Последний может быть проявлением и острой дистонической реакции. Возможны окулогирные кризы. Поздняя дистония часто сопровождается стереотипиями и акатизией. Течение поздней дистонии вариабельно, в молодом возрасте возможны спонтанные ремиссии.
Поздняя дистония плохо поддается лечению. Иногда помогают холинолитики (обычно высокие дозы), резерпин, клоназепам, баклофен. Наиболее эффективный способ лечения – повторные инъекции ботулотоксина.
Лекарственный тремор. Тремор может возникать как побочный эффект целого ряда лекарственных средств. Чаще всего дрожание вызывают бета-адреномиметики (Изопротеренол, тербуталин), препараты лития, антиконвульсанты (вальпроевая кислота, дифенин, нейролептики), трициклические антидепрессанты, ингибиторы моноаминоксидазы (МАО), дофаминергические средства, психостимуляторы, метилксантины (кофеин, эуфиллин, теофиллин), кортикостероиды, антигистаминные и антидиабетические средства, пиндолол, новокаинамид, циметидин, холинолитики, циклоспорин A, антагонисты кальция (нифедипин, флунаризин). Лекарственные средства чаще всего вызывают усиленный физиологический тремор. Однако резерпин, нейролептики, препараты лития, антагонисты кальция (флунаризин, циннаризин), амиодарон могут вызывать тремор покоя или грубый постурально-кинетический тремор.
Иногда тремор возникает с началом приема препарата, но нередко становится заметен лишь через несколько недель лечения. После отмены препарата или уменьшения его дозы тремор обычно уменьшается или проходит. Но иногда (например, при приеме препаратов лития) стойкий тремор сохраняется длительное время после отмены препарата.
Лекарственная акатизия – неусидчивость, непреодолимая потребность двигаться, чтобы уменьшить чувство внутреннего напряжения и дискомфорта. Акатизия может возникать в течение нескольких дней после назначения или увеличения дозы нейролептиков, значительно реже – резерпина, трициклических антидепрессантов, флуоксетина (Прозака), леводопы и агонистов дофаминовых рецепторов, ингибиторов МАО, антагонистов кальция или отмены бензодиазепинов (острая акатизия), иногда на фоне длительного лечения нейролептиками (поздняя акатизия). Иногда при экстрапирамидных или психиатрических заболеваниях акатизия возникает спонтанно, в отсутствие приема лекарственных средств. Патогенез акатизии неизвестен, но предположительно он связан с нарушением функционирования дофаминергической (мезокортикальной), возможно, опиоидной или норадренергической систем. Акатизия чаще развивается у женщин среднего возраста. Двигательная активность, сопровождающая акатизию, бывает разнообразной, но нередко имеет стереотипный характер – от постукивания пальцами и раскачивания ногами до беспрерывных и бесцельных «шатаний из угла в угол». При появлении акатизии препарат, вызвавший ее, следует отменить – в этом случае акатизия, как правило, регрессирует в течение нескольких дней или недель, но иногда задерживается на несколько месяцев. Если препарат нельзя отменить полностью, нужно снизить его дозу или заменить другим, более безопасным средством. Уменьшению акатизии способствуют холинолитики, бензодиазепины, бета-блокаторы (пропранолол), амантадин. В резистентных случаях иногда прибегают к пирацетаму, амитриптилину, симпатолитикам (резерпину), клонидину (Клофелину). Иногда акатизия возникает при длительном лечении нейролептиками и длительно сохраняется после их отмены (поздняя акатизия).
Хорея, вызванная оральными контрацептивами, обычно возникает у женщин, перенесших в детстве малую хорею. Часто это происходит в первые 3 месяца после начала приема препарата. Гиперкинез развивается подостро, может быть асимметричным или односторонним и регрессирует при отмене гормональных средств.
Поздняя дискинезия. Под поздней дискинезией в широком смысле понимают любой гиперкинез, который развивается на фоне длительного приема лекарственных препаратов, блокирующих дофаминовые рецепторы (нейролептики, метоклопрамид (Церукал)), и стойко сохраняется после отмены препарата (по крайней мере в течение 1 мес.). Поздняя дискинезия может проявляться гиперкинезом различного характера: хореиформным или хореоатетоидным гиперкинезом, дистонией, тиком, акатизией, миоклонией или их сочетанием. В узком смысле термином «поздняя дискинезия» обозначают самый распространенный ее вариант – хореиформный гиперкинез, преимущественно вовлекающий орофациальную область и язык (букколингвомастикаторный синдром).
Поздняя дискинезия возникает примерно у 20% больных, длительное время принимающих нейролептики. Обычно поздняя дискинезия развивается после многомесячного лечения, но вероятность ее развития не зависит ни от его общей длительности, ни от суммарной дозы нейролептиков. В ряде случаев дискинезия возникает уже после 1–3 мес. лечения, иногда даже после отмены нейролептика, способного до определенного момента маскировать ее проявления. Патогенез поздней дискинезии остается неясным. Развитие гиперкинеза связывают с гиперчувствительностью дофаминовых (D1) рецепторов в стриатуме, что приводит к усилению активности так называемого прямого пути, который следует от стриатума непосредственно к выходным структурам базальных ганглиев (медиальному сегменту бледного шара и ретикулярной части черной субстанции) и далее через таламус к коре и в норме облегчает адекватные в данный момент движения, инициированные в премоторной коре. Альтернативное или дополняющее объяснение – дисфункция ГАМКергических стриарных нейронов и снижение активности берущего от них начало непрямого пути, который следует от стриатума к выходным структурам базальных ганглиев через латеральный сегмент бледного шара и субталамическое ядро и в норме приводит к торможению неадекватных движений. Важную патогенетическую роль, возможно, играет окислительный стресс, индуцируемый нейролептическими препаратами.
Поздняя дискинезия чаще развивается у больных пожилого возраста, страдающих аффективными расстройствами и сахарным диабетом. Кроме того, она чаще возникает у женщин, а также у лиц, у которых ранее отмечались нейролептические экстрапирамидные синдромы. При применении тиоридазина (Сонапакса) и так называемых атипичных нейролептиков (таких как клозапин, сульпирид, тиаприд), в меньшей степени влияющих на стриарные дофаминовые рецепторы, риск поздней дискинезии ниже. Добавление к нейролептикам холинолитических корректоров не только не предупреждает развитие поздней дискинезии, но и, по-видимому, приближает момент ее клинического дебюта.
Чаще всего поздняя дискинезия проявляется в виде хореиформной оробукколингвальной (букколингвомастикаторной) дискинезии с высовыванием языка, облизыванием губ, сосательными и жевательными движениями, открыванием рта, гримасничаньем. Иногда этот гиперкинез сопровождается также блефароспазмом, движением бровей, отведением глазных яблок. При вовлечении дыхательных мышц возникают эпизоды тахипноэ, неритмичное прерывистое дыхание или необычные вокализации (респираторная дискинезия). В тяжелых случаях вовлекаются мышцы гортани и глотки с нарушением речи и глотания. Хореиформный характер гиперкинеза становится очевидным, когда он генерализуется и вовлекает мышцы конечностей и туловища. Больной может совершать туловищем раскачивающиеся или закручивающиеся движения, иногда это сопровождается характерными движениями таза (копуляторная дискинезия). В отличие от истинной хореи, хореиформные движения имеют более стереотипный, регулярный характер. Изредка поздняя дискинезия протекает без вовлечения мышц лица.
Поздняя дискинезия может проявляться и в форме дистонии (поздняя дистония – см. выше), миоклонии (поздняя миоклония), моторных и вокальных тиков (поздний тик), акатизии (поздняя акатизия). Нередко различные варианты гиперкинезов сочетаются друг с другом, а также со стереотипиями (относительно сложными двигательными актами, напоминающими целенаправленные действия, например потирание рук или головы, застегивание и расстегивание пуговиц на одежде) или тремором (тремором покоя или постуральным тремором – «поздним тремором»). Поздняя дистония и поздняя акатизия – два наиболее инвалидизирующих варианта поздней дискинезии.
Лечение. Поздняя дискинезия плохо поддается лечению. При отмене нейролептика, снижении его дозы либо замене его клозапином (Лепонексом) или другим атипичным нейролептиком можно ожидать медленного спонтанного регресса гиперкинеза в течение нескольких недель, месяцев или лет. Но у значительной части больных дискинезия после отмены препарата остается без изменений. Чем моложе больной и чем короче был курс лечения нейролептиками, тем выше вероятность спонтанной ремиссии.
Иногда отмена препарата провоцирует усиление гиперкинеза. При этом возникает искушение вновь назначить то же средство. Однако ухудшение при отмене нейролептика носит временный характер, тогда как при продолжении его приема в той же дозе шансы на спонтанное улучшение значительно снижаются, хотя оно все же возможно. Симптоматическая терапия определяется ведущим типом гиперкинеза. При наиболее часто встречающемся хореиформном гиперкинезе в первую очередь следует назначить средства, улучшающие ГАМКергическую передачу (клоназепам, диазепам, баклофен, вальпроат натрия), в ряде случаев эффективны центральные симпатолитики (резерпин), сульпирид (Эглонил) или оланзапин (Зипрекса). В резистентных случаях можно испробовать карбамазепин, антагонисты кальция (верапамил, дилтиазем, нифедипин), малые дозы агонистов дофаминовых рецепторов (бромокриптин), препараты магния, Клофелин. У отдельных больных удается также добиться улучшения с помощью средств, усиливающих холинергическую передачу: предшественников ацетилхолина (холин), антихолинэстеразных препаратов (такрин), Меклофеноксата (ацефена). В то же время холинолитики при хореиформном гиперкинезе вызывают усиление дискинезии и должны быть отменены, но могут быть полезны при поздней дистонии (наряду с симпатолитиками, клоназепамом и клозапином). При поздней акатизии наиболее эффективны бета-блокаторы или резерпин. Учитывая возможную патогенетическую роль окислительного стресса в повреждении нейронов базальных ганглиев, в комплекс лечения следует включать витамин E или другие антиоксиданты.
Злокачественный нейролептический синдром – редкое осложнение нейролептической терапии. Генез остается невыясненным, но предполагают, что в его механизме играет роль блокада дофаминовых рецепторов в полосатом теле и гипоталамусе. Это косвенно подтверждается случаями возникновения аналогичного синдрома после внезапной отмены препаратов леводопы. Не исключается врожденная предрасположенность. Синдром обычно развивается в первые дни лечения нейролептиком либо после резкого увеличения его дозы. Развитию синдрома могут способствовать интеркуррентная инфекция, нарушения водно-электролитного баланса (в частности, дегидратация или гипонатриемия), одновременное назначение препарата лития. Чаще всего синдром возникает у молодых мужчин при применении нейролептиков пролонгированного действия.
Клинически синдром проявляется триадой симптомов: гипертермия (до 40–42°С), генерализованная мышечная ригидность, угнетение сознания (ступор, кома). Картину дополняют вегетативные расстройства: бледность, потливость, тахикардия. В ряде случаев отмечаются тремор, дистония, хореиформный гиперкинез, изредка – эпилептические припадки. Симптоматика нарастает в течение 1–3 сут. Постоянное напряжение мышц может приводить к их некрозу, который проявляется увеличением уровня креатинфосфокиназы в крови и миоглобинурией с последующей почечной недостаточностью. В 15–25% случаев синдром заканчивается летальным исходом, связанным с тромбоэмболией легочной артерии, почечной недостаточностью, острой сердечной недостаточностью, пневмонией. У остальных больных в течение нескольких дней или недель наступает регресс симптомов.
Лечение состоит в немедленном прекращении приема нейролептика или другого антидофаминергического средства, лития, коррекции водно-электролитных нарушений. При нарушении дыхания и глотания необходимы интубация и ИВЛ, введение назогастрального зонда для кормления и введения лекарств. Для уменьшения ригидности назначают амантадин (внутрь или внутривенно), бензодиазепины, иногда бромокриптин и препараты леводопы, но эффект последних непостоянен. Для предупреждения тромбоза глубоких вен голени назначают малые дозы гепарина. Для снижения температуры используют антипиретики и методы внешнего охлаждения. При острой почечной недостаточности показан гемодиализ. Возобновить лечение нейролептиком (желательно другим) можно лишь после регресса всех симптомов осложнения, начиная с малых доз.
Серотониновый синдром возникает при применении серотониномиметических препаратов (трициклические и тетрациклические антидепрессанты, ингибиторы обратного захвата серотонина и др.), особенно в комбинации с препаратами, усиливающими действие серотонина (ингибиторы МАО, препараты лития, бромокриптин, пентазоцин). Как правило, серотониновый синдром развивается в течение нескольких часов или дней после начала лечения серотониномиметическим средством или увеличения его дозы. Клиническая картина включает миоклонии, тремор, ригидность, оживление рефлексов, особенно в ногах, клонус стоп, атаксию, которые обычно сопровождаются возбуждением, спутанностью сознания и вегетативными нарушениями (субфебрильной температурой, тошнотой, диареей, головной болью, гиперемией лица, ознобом, профузным потоотделением, учащением дыхания и пульса, колебаниями АД, расширением зрачков). В тяжелых случаях возможны высокая лихорадка, эпилептические припадки, опистотонус, ДВС-синдром, миоглобинурия, почечная недостаточность, кома. Симптоматика тяжелого серотонинового синдрома напоминает злокачественный нейролептический синдром (повышение активности серотонинергической системы приводит к торможению дофаминергических нейронов).
Лечение. Серотониновый синдром обычно проходит самостоятельно в течение нескольких часов или дней после отмены серотониномиметического препарата. Однако описаны случаи с летальным исходом. Лечение включает главным образом симптоматические меры. Антагонисты серотонина (метисергид, ципрогептадин (Перитол), бета-адреноблокаторы (пропранолол) способствуют более быстрому восстановлению.