pirads 5 предстательной железы что это такое
PIRADS-шкалы
Рак простаты
Основной целью МРТ-исследования ПЖ является определение и локализация изменений, которые соответствуют клинически значимому РПЖ.
Последние исследования показали, что в зависимости от локализации и степени изменения ткани ПЖ мпМРТ способна выявить среднюю и высокую степень аплазии при размерах опухоли менее 5 мм.Однако нет общепризнанного мнения по критериям клинически незначимого РПЖ. В системе PI-RADSv2 процесс выявления клинически значимого рака предполагает стандартизацию отчета мпМРТ и корреляцию с патологическими изменениями для клинических и исследовательских задач. Для PI-RADSv2 клинически значимый РПЖ определяется при патоморфологическом (гистологическом) исследовании как участок с суммой баллов по шкале Глисона > 7 (включая 3+4 с явной, но не доминирующей частью баллов по Глисону 4) и / или объемом более 0,5 см3, и / или с экстрапростатической инвазией.
Информация, полученная с помощью Т2-ВИ, ДВИ, ДКУ, а также иногда МР-спектроскопии, градуируется по предложенной системе PI-RADS. PI-RADS-градация определяет вероятность нахождения РПЖ, его агрессивность (косвенно), локализацию и возможность экстрапростатического распространения.
Показания к МРТ
Градации PI-RADSv2
Определение рисков наличия клинически значимого РПЖ
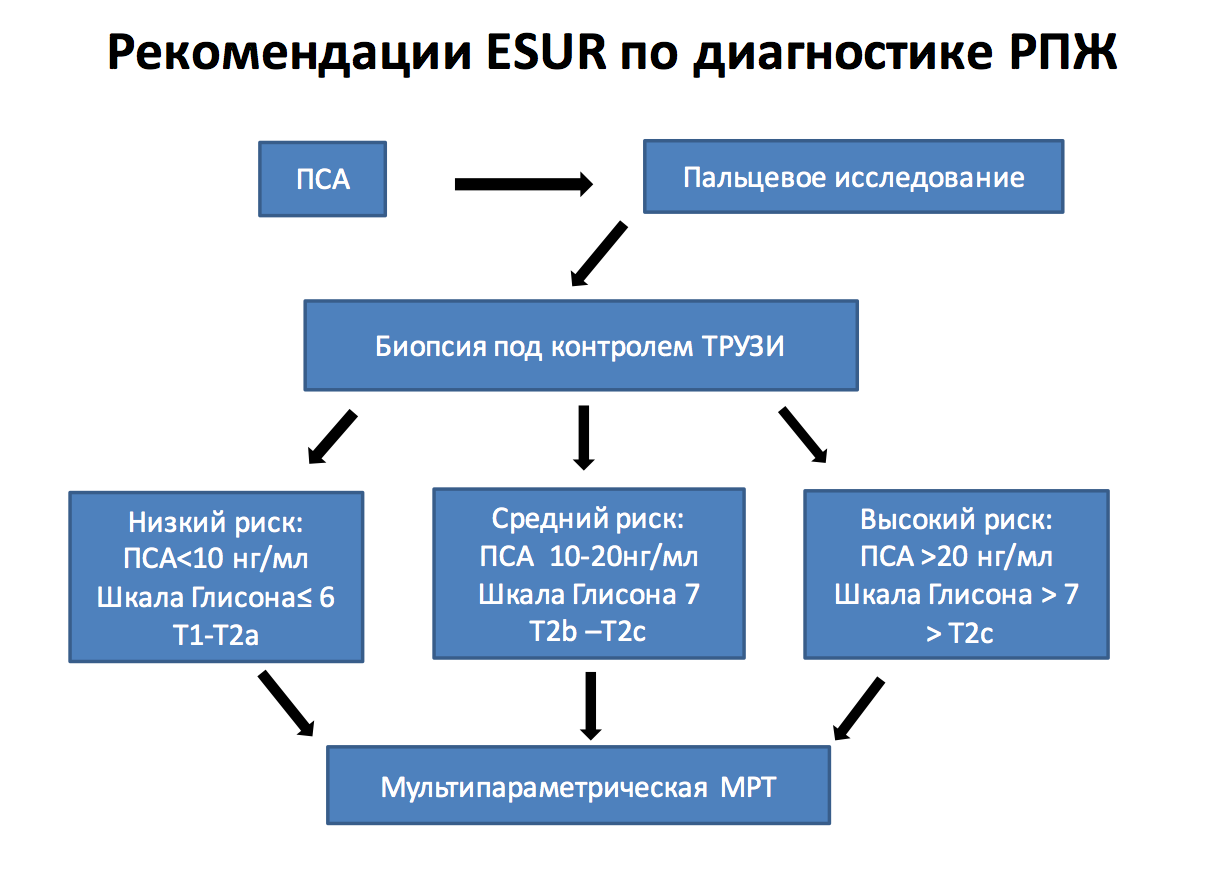
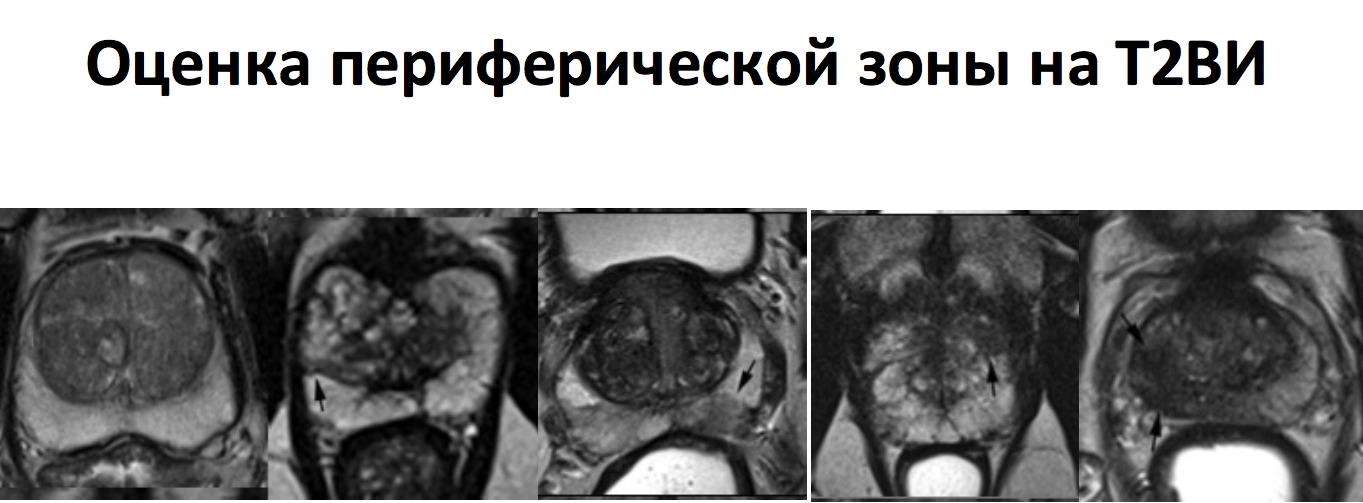
Шкала градаций PIRADS для Т2-ВИ (для периферической зоны)
Характеристика структуры паренхимы периферической зоны
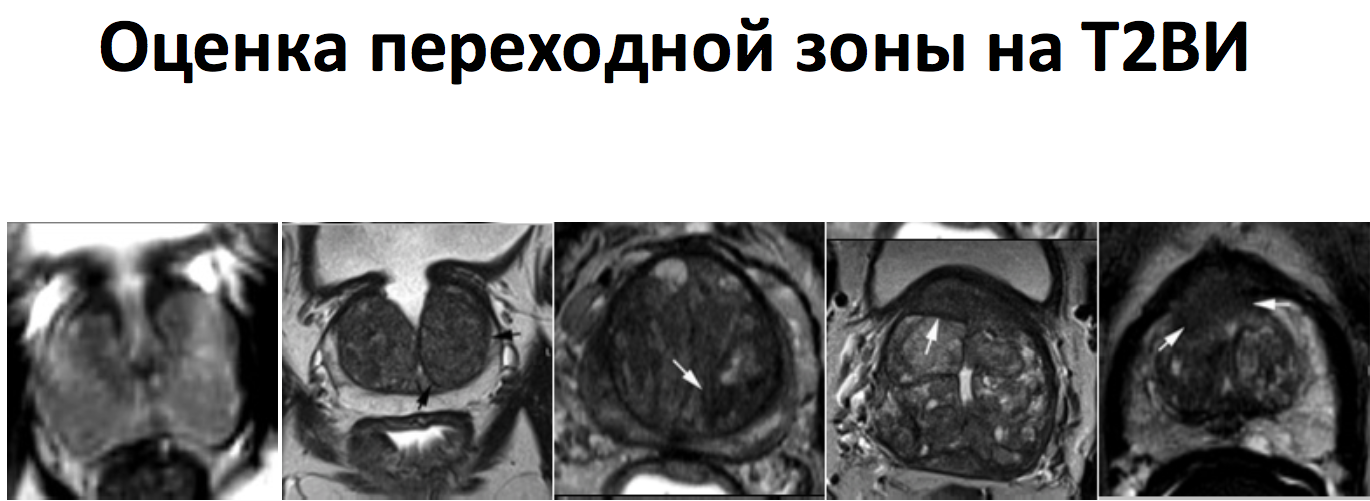
Шкала градаций PI-RADS для Т2-ВИ для транзиторной (переходной) зоны.
Магнитно-резонансная томография (МРТ) в Санкт-Петербурге
Запишитесь на МРТ по телефону (812) 493-39-22 или заполните форму
Расписание приема МРТ:
ЦМРТ «Нарвский»
(812) 493-39-22
в четверг прием с 8-00 до 23-00
и воскресенье прием с 8-00 до 23-00
ул. Ивана Черных,29
МРТ аппарат 1,5 Тл
суббота :
ЦМРТ «Старая деревня»
(812) 493-39-22
прием 8-00 до 23-00
ул. Дибуновская,45
МРТ аппарат 1,5 Тл
Прием в “РНХИ им. проф. А.Л. Поленова” прекращен по техническим причинам и
перенесен в ЦМРТ
МРТ оценка вероятности рака предстательной железы
Оценка вероятности рака предстательной железы (РПЖ) с помощью МРТ происходит по системе PiRADS второго пересмотра (http://www.acr.org/Quality-Safety/Resources/PIRADS). Смысл системы состоит а раздельной оценке периферической и переходной зон с оценкой признаков опухоли на Т2-взвешенных МРТ предстательной железы, диффузионно-взвешенных МРТ предстательной железы и МРТ предстательной железы с динамическим контрастированием. Каждая из зон оценивается по 5-бальной шкале, контрастирование либо есть, либо его нет. Затем все результаты оценки по шкалам сводятся в единую оценку вероятности РПЖ, выставляемую в виде баллов.
РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ: ДИАГНОСТИКА, ЛЕЧЕНИЕ, МОНИТОРИНГ.
О.В. Щербина,В.C. Сакало П.Н. Ковалев
РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ: ДИАГНОСТИКА, ЛЕЧЕНИЕ, МОНИТОРИНГ.
Одним из высокочувствительных тестов для ранней диагностики рака предстательной железы(РПЖ) является определение уровня простатического специфического антигена (ПСА) в сыворотке крови (Karazanashvili G., Abrahamsson P.A., 2003). С 80-х годов XX века в Западной Европе, США, Канаде определение уровня ПСА стало обязательным клиническим анализом. В странах, где налажен скрининг рака предстательной железы, мужчины старше 50 лет регулярно проходят обследование с определением уровня ПСА в сыворотке крови.
Таким образом, концентрация ПСА характеризуется органоспецифичностью, но не канцероспе-цифичностью и ее умеренное повышение не всегда свидетельствует о наличии злокачественного процесса. Наибольшие проблемы в установлении диагноза возникают в случае колебания уровня ПСА от 4,1 до 10,0 нг/мл (так называемая «серая зона»). Такое явление отмечается не только при опухолях предстательной железы, но и других заболеваниях, в первую очередь при доброкачественной гиперплазии предстательной железы. Следует отметить, что повышение уровня ПСА до 20 нг/мл и выше является высокоспецифичным для рака предстательной железыРПЖ. Для повышения чувствительности и, особенно, специфичности, а также дифференциально-диагностических возможностей метода предложены дополнительные показатели ПСА (Лоран О. Б. и соавт., 1999; Brawer M.K., 1999).
Скорость изменения уровня ПСА. Уровень ПСА быстрее повышается у больных раком предстательной железы по сравнению с таковым у пациентов с доброкачественной гиперплазией этого органа. Скорость изменения, превышающая 0,75 нг/мл в течение года, позволяет более надежно дифференцировать рак от доброкачественной гиперплазии. Этот тест широко не используют из-за необходимости быстрой и точной диагностики рака предстательной железы.
Определение свободного и общего ПСА и их соотношения. Определяют концентрацию свободного и общего ПСА и рассчитывают соотношение: свободный ПСА/общий ПСА. При злокачественных опухолях предстательной железы уменьшена доля свободной фракции ПСА и увеличена доля антигена, связанного с а1-антихимотрипсином. Если показатель соотношения свободного и общего ПСА не превышает 0,15, это с высокой достоверностью свидетельствует о наличии рака предстательной железы.
Большинство исследователей считает, что в первую очередь уровень свободного ПСА необходимо определять при значениях общего ПСА в пределах «серой зоны», то есть 4,1-10,0 нг/мл. Но наш опыт свидетельствует, что для исключения ложноположительных результатов свободный ПСА необходимо определять и при концентрации общего ПСА также в пределах 10,1-20,0 нг/мл. При уровне общего ПСА ниже 4,0 нг/мл также отмечается рак простаты, поэтому определение свободного ПСА и у этой категории пациентов может помочь в установлении диагноза.
Высокий уровень ПСА с высокой достоверностью свидетельствует об экстракапсулярном распространении опухоли, а также о метастазах в тазовых лимфатических узлах или об отдаленных метастазах, в первую очередь в скелете. Большое значение имеет определение уровня ПСА для контроля эффективности лечения и ранней диагностики рецидивов (Amis E.S. Jr. et al., 2000). После радикальной про-статэктомии при отсутствии экстракапсулярной инвазии и метастазов в организме больного не остается ткани предстательной железы, поэтому уровень ПСА резко снижается. Верхний предел уровня ПСА составляет при этом 0,05-0,1 нг/мл. Важным критерием радикальности является также стойкий низкий уровень ПСА у пациентов при динамическом наблюдении. Стойкое и последовательное нарастание концентрации ПСА должно настораживать относительно рецидива или генерализации процесса.
При эффективной лучевой и/или гормональной терапии отмечается снижение уровня этого опухолевого маркера не менее чем на 50% от исходного. На основании повышения уровня ПСА можно установить наличие рецидива опухоли после проведения лечения. Повышение уровней ПСА в сыворотке крови может регистрироваться за несколько месяцев до появления клинических признаков прогрессирования заболевания. При развитии гор-монорезистентности отмечается повышение уровня ПСА, что коррелирует с клиническими проявлениями.
Для диагностики метастазов в регионарных лимфатических узлах чаще всего применяют КТ и МРТ. При проведении КТ признаками метастазов является увеличение размеров лимфоузлов (1 см и более) и изменение их формы. Следует отметить, что при помощи КТ невозможно выявить метастазы в лимфатических узлах без увеличения их размеров. Поэтому метастазы небольших размеров и микрометастазы при КТ не диагностируют. Для повышения точности диагностики предлагают проводить пункцию увеличенных лимфоузлов под контролем КТ. При проведении МРТ признаками метастазов являются увеличение размеров лимфатических узлов (>1 см) и изменение их формы. Трудности диагностики заключаются в том, что метастазы могут быть также и в узлах нормального размера, поэтому МРТ не позволяет выявить метастазы в неувеличенных лимфатических узлах. Решением этой проблемы может быть использование МРТ-контрастных веществ со сверхмалыми парамагнитными частицами окиси железа, специфичных к лимфатическим узлам. В нормальных лимфатических узлах с функционирующими макрофагами происходит фагоцитоз этого вещества, что обусловливает снижение интенсивности сигнала на МРТ-изображении. В узлах с метастазами из-за отсутствия в них макрофагов не проходит захват контрастного вещества, и поэтому интенсивность сигнала после его введения не изменяется. Применение таких контрастных веществ позволяет повысить чувствительность метода в диагностике метастазов в лимфатических узлах благодаря их выявлению в узлах нормального размера.
МРТ по сравнению с остеосцинтиграфией имеет более высокую специфичность, поэтому в большинстве случаев применяется при сомнительных результатах, полученных при использовании других методов лучевой диагностики метастазов в скелете. При остеобластических метастазах, наиболее характерных для рака предстательной железы, снижается интенсивность сигнала как на Т1-, так и на Т2-взве-шенных изображениях. При помощи МРТ можно проводить контроль эффективности лечения по поводу костных метастазов. Критерием эффективности лечения при проведении МРТ-исследований является повышение интенсивности сигнала на Т1-взвешенных изображениях.
Пункционную биопсию предстательной железы выполняют с использованием трансректального или промежностного доступа. Оптимальным является проведение этой диагностической процедуры под контролем ультразвукового исследования. Если повышен уровень ПСА, но опухоль не пальпируется и не визуализируется при трансректальном ультразвуковом исследовании, показано проведение мультифокальной биопсии предстательной железы. При гистологическом исследовании биопсийного материала определяют морфологическую структуру опухоли и степень ее диф-ференцировки, что имеет большое значение для выбора тактики лечения.
Радикальную простатэктомию выполняют пациентам с локализованными высоко- и среднедиф-ференцированными опухолями, при отсутствии серьезных противопоказаний к операции, в первую очередь со стороны сердечно-сосудистой системы, и при вероятности прожить не менее 10 лет. В случае этого вмешательства удаляют предстательную железу, семенные пузырьки, простатическую часть уретры, парапростатическую клетчатку, тазовые лимфоузлы. Современная техника выполнения радикальной простатэктомии учитывает анатомию дорсального венозного комплекса, венозного сплетения Санторини, обеспечивает сохранение бокового сосудисто-нервного пучка с одной стороны. Применение такого анатомического подхода позволяет уменьшить объем кровопотери, обеспечить удержание мочи после операции, сохранить сексуальную активность. Благодаря радикальному хирургическому лечению возможно достичь полного излечения. К сожалению, в нашей стране поздняя диагностика заболевания не дает возможности широко применять этот эффективный метод лечения.
При проведении дистанционной лучевой терапии на первичную опухоль подводят суммарную очаговую дозу до 70 Гр (за два этапа терапии с интервалом между ними 2-3 нед). Разовая очаговая доза при этом составляет 2 Гр. При поражении метастазами регионарных лимфатических узлов проводят их облучение до достижения суммарной дозы 45 Гр. При этом лучевую терапию комбинируют с гормонотерапией. В Западной Европе, США при лечении больных с локализованной опухолью широко применяют имплантационную брахитера-пию с радионуклидами 125 I или 103 Pd.
Преимущества имплантационной брахитерапии:
1. Высокая частота выздоровления больных (результаты лечения приравниваются к таковым после радикальной простатэктомии).
2. Пациента выписывают из клиники на следующий день после имплантации, он возвращается к нормальной жизнедеятельности в течение нескольких дней.
3. При брахитерапии подводимая доза в 2-3 раза выше, чем при дистанционной лучевой терапии, и не повреждаются окружающие здоровые ткани.
4. Высокое качество жизни пациентов: недержание мочи развивается меньше чем у 4% больных, потенция сохраняется более чем у 75% пациентов.
5. Процедура хорошо переносится пациентами преклонного и старческого возраста.
При имплантационной брахитерапии с использованием зерен 125 I к опухоли подводится очаговая доза 160 Гр. В случае предварительного проведения дистанционной лучевой терапии (45 Гр) подводится доза 120 Гр. При применении 103 Pd к опухоли подводится доза 115 Гр, а в случае предварительного проведения дистанционной лучевой терапии
Билатеральная орхиэктомия остается одним из наиболее часто используемых методов лечения больных раком предстательной железы, особенно при генерализации процесса.
Эстрогенотерапию в качестве терапии первой линии применяют все реже в связи с высокой частотой осложнений со стороны сердечно-сосудистой системы. Эстрогены проявляют как антигонадо-тропный эффект (уменьшение продуцирования гонадотропних гормонов гипофизом), так и антигонадный (торможение образования тестостерона в яичках). Для базового курса применяют инъекции эстрогенов, как правило, 2% масляного раствора гексэстрола 3 мл в течение 3 мес. Для поддерживающей терапии применяют препараты в форме таблеток (этинилэстрадиол, эстрамустин) по схеме: 1 таблетка 3 раза в сутки или 2 таблетки 2 раза в сутки. Как правило, эстрогены назначают в интер-миттирующем режиме, так как осложнения гормонотерапии иногда тяжелее, чем само заболевание (инфаркт миокарда, тромбоэмболия легочной артерии, острое нарушение мозгового кровообращения, тромбофлебит).
Синтетические аналоги лютеинизирующего гормона рилизинг-гормона, действуя на уровне гипота-ламо-гипофизарной оси, приводят к медикаментозной кастрации. Гозерелин вводят под кожу передней брюшной стенки в дозе 3,6 мг 1 раз в 28 дней или в дозе 10,8 мг 1 раз в 3 мес. Трипторелин вводят внутримышечно в дозе 3,75 мг 1 раз в 28 дней.
Сочетание применения нестероидных антианд-рогенов с медикаментозной или хирургической кастрацией получило название максимальной анд-рогенной блокады. При этом угнетается или прекращается продукция яичковых и надпочечниковых андрогенов. В клинической практике максимальная андрогенная блокада чаще всего достигается с помощью следующих методов: билатеральная орхиэктомия + применение флутамида в дозе 250 мг 3 раза в сутки; билатеральная орхиэктомия + прием бикалутамида в дозе 50 мг/сут; гозерелин в дозе 3,6 мг 1 раз в 28 дней + флутамид по 250 мг 3 раза в сутки; гозерелин в дозе 3,6 мг 1 раз в 28 дней + би-калутамид в дозе 50 мг/сут; трипторелин в дозе 3,75 мг 1 раз в 28 дней + флутамид по 250 мг 3 раза в сутки; трипторелин в дозе 3,75 мг 1 раз в 28 дней + бикалутамид в дозе 50 мг/сут.
Максимальная андрогенная блокада как самостоятельный метод является золотым стандартом при местно-распространенных и генерализованных формах рака предстательной железы. Но независимо от вида гормональной терапии у больных спустя некоторое время развивается гормонорезистент-ность и заболевание прогрессирует. Для отдаления начала развития гормонорезистентности лечение рекомендуется проводить в интермиттирующем режиме, что позволяет дольше сберечь чувствительность андрогензависимых и андрогенчувствитель-ных клонов опухолевых клеток к гормональным средствам. При этом значительно снижаются затраты на лечение и улучшается качество жизни благодаря уменьшению побочных эффектов длительной гормональной терапии.
Химиотерапия по поводу рака предстательной железы цитостатическими средствами имеет вспомогательное значение, что объясняется низкой чувствительностью к ним опухолей простаты. Применяется лишь у больных с прогрессирующим раком предстательной железы в случае первичной или приобретенной гормонорезистентности.
При мониторинге больных после радикальной про-статэктомии рекомендуем проводить следующие исследования:
При контроле эффективности лечения и мониторинге у больных после лучевой терапии рекомендуем проводить следующие исследования:
У больных, которым проводят гормональную терапию, рекомендуем выполнять следующие исследования:
Александров В.П., Карелин М.И. (2004) Рак предстательной железы. Издательский дом СПбМАПО, СПб, 148 с.
Возианов А.Ф., Резников А.Г., Клименко И.А. (1999) Эндокринная терапия рака предстательной железы. Наук. думка, К., 280 с.
Воз1анов С.О., Лковий В.М., Пасечшков С.П., Харе-ба Г.Г. (2004) Рак передапхурово! залози. Книга плюс, К., 182 с.
Григоренко В.М., Клименко 1.О., Сакало В.С., Щербь на О.В., Мрачковський В.В. (2002) Сучасн принципи лпсу-вання раку передм1хурово! залози. Роль антиандрогешв (Метод. рекомендацЦ). К., 28 с.
Громов А.И. (1999) Ультразвуковое исследование предстательной железы. Биоинформсервис, М., 136 с.
Клименко И.А. (1998). Рак предстательной железы. Журн. практ. врача, 2: 21-24.
Лоран О.Б., Пушкарь Д.Ю., Франк Г.А. (1999) Простат-специфический антиген и морфологическая характеристика рака предстательной железы. Медпресс, М., 144 с.
Мечев Д.С., Щербша О.В., Чеботарьова Т.1. (2001) Су-часн1 пщходи до променевого л1кування раку передм^хурово! залози та його метастаз1в. Укр. рад1ол. журн., 9(3): 331-337.
Пушкарь Д.Ю. (2003) Простат-специфический антиген и биопсия предстательной железы. Медпресс-информ, М., 160 с.
Щербша О.В., Мечев Д.С., Сакало В.С., Бабш Я.С., Гладка Л.Ю. (2004) Променев1 методи в д1агностищ та оцшщ ефективносп лпсування раку передм^хурово! залози (Навч. поибник). 1ВО «Медицина Укра!ни», К., 96 с.
Abuzallouf S., Dayes I., Lukka H. (2004) Baseline staging of newly diagnosed prostate cancer: a summary of the literature. J. Urol., 171(6 Pt 1): 2122-2127.
Amis E.S. Jr., Bigongiari L.R., Bluth E.I., Bush W.H. Jr., Choy-ke P.L., Fritzsche P.J., Holder L.E., Newhouse J.H., Sandler C.M., Segal A.J., Resnick M.I., Rutsky E.A. (2000) Post-treatment follow-up of prostate cancer. American College of Radiology. ACR Appropriateness Criteria. Radiology, 215 (suppl.): 773-778.
Bolla M. (2003) Treatment of localized or locally advanced prostate cancer: the clinical use of radiotherapy EAU Update
Brawer M.K. (1999) Prostate-specific antigen: current status. СА Cancer J. Clin., 49(5): 264-281.
Forman J.D., Lee W.R., Roach M. 3rd, Perez C.A., Beyer D.C.,
Blasko J.C., Hussey D.H., Paryani S.B., Pollack A., Potters L.,
Scardino P., Schellhammer P., Leibel S. (2000) Staging evaluation for patients with adenocarcinoma of the prostate. American College of Radiology. ACR Appropriateness Criteria. Radiology, 215
ПРИМЕНЕНИЕ СИСТЕМЫ PI-RADS В МР-ДИАГНОСТИКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Дата публикации – 17.07.2020
Формат и размер – PDF/6,3 МБ
Серия «Лучшие практики лучевой и инструментальной диагностики»
Основана в 2017 году
Организация-разработчик: Государственное бюджетное учреждение здравоохранения города Москвы «Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы»
Составители:
Николаев А. Е. – младший научный сотрудник отдела развития качества радиологии ГБУЗ «НПКЦ ДиТ ДЗМ»
Блохин И. А. – младший научный сотрудник отдела развития качества радиологии ГБУЗ «НПКЦ ДиТ ДЗМ»
Шапиев А. Н. – техник координационного сектора ГБУЗ «НПКЦ ДиТ ДЗМ»
Гончар А. П. – младший научный сотрудник отдела развития качества радиологии ГБУЗ «НПКЦ ДиТ ДЗМ»
Чернина В. Ю. – младший научный сотрудник отдела развития качества радиологии ГБУЗ «НПКЦ ДиТ ДЗМ»
Сучилова М. М. – младший научный сотрудник отдела развития качества радиологии ГБУЗ «НПКЦ ДиТ ДЗМ»
Гомболевский В. А. – к.м.н., руководитель отдела развития качества радиологии ГБУЗ «НПКЦ ДиТ ДЗМ»
Морозов С. П. – д.м.н., профессор, главный внештатный специалист по лучевой и инструментальной диагностике ДЗМ и Минздрава России по ЦФО РФ, директор ГБУЗ «НПКЦ ДиТ ДЗМ»
Применение системы PI-RADS в МР-диагностике предстательной железы : методические рекомендации / сост. А. Е. Николаев, И. А. Блохин, А. Н. Шапиев [и др.] // Серия «Лучшие практики лучевой и инструментальной диагностики». – Вып. 31. – М. : ГБУЗ «НПКЦ ДиТ ДЗМ», 2019. – 26 с.
Рецензенты:
Нуднов Николай Васильевич – д. м. н, профессор, заместитель директора по научной работе ФГБУ «РНЦРР» Минздрава России
Бродецкий Борис Михайлович – к.м.н., заведующий отделением лучевой диагностики ГБУЗ «ГКБ им. М. П. Кончаловского ДЗМ»
Данные методические рекомендации являются адаптированной версией Prostate Imaging Reporting and Data System Version 2.1: 2019 (классификационная система оценки данных и составления заключения при интерпретации МРТ предстательной железы PI-RADS Американского радиологического общества) и предназначены для врачей-рентгенологов, рентгенолаборантов, руководителей здравоохранения в медицинских учреждениях амбулаторно-поликлинического звена. Рекомендации разработаны с целью стандартизировать первичные и повторные исследования, оценить лечение и тактику ведения пациентов с подозрением на клинически значимый рак предстательной железы.
Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения
© Департамент здравоохранения города Москвы, 2019
Pirads 5 предстательной железы что это такое
к.м.н., руководитель центра лечения заболеваний простаты Европейского медицинского центра
Понять радиолога
Радиолог расшифровывает мпМРТ предстательной железы, а уролог транслирует эти данные в практику. Чтобы мпМПР приобрела клиническую значимость, потребуются скрупулезные образовательные мероприятия. Об эволюции интерпретационной шкалы мпМРТ и взаимопонимании между урологами и радиологами — в материале УС.
В августе 2016 года Benjamin Spilseth et al. направили членам Society of Abdominal Radiology и Society of Urologic Oncology опросники. Оценив результаты, авторы составили пожелания к доработке шкалы PI-RADSv2 (Prostate Imaging Reporting and Data System) и отметили основные разночтения межэкспертной оценки. Едва ли не главной находкой стало экстремально низкое количество откликнувшихся специалистов: 12 % радиологов и 8 % урологов. “Недостаток опыта в МРТ предстательной железы, вероятно, предопределил неучастие в опросе”, — отметили Benjamin Spilseth et al., анализируя исследование.
PI-RADSv2
PI-RADSv2 — это система унифицированного подхода к интерпретации магнитно-резонансной томографии (МРТ) предстательной железы. Оценочные категории PI-RADSv2 суммируют уровни подозрения или риска рака предстательной железы (РПЖ) и используются для определения плана диагностики и лечения РПЖ.
По данным PI-RADSv2 можно сделать вывод о целесообразности биопсии простаты или выбрать тактику активного наблюдения Шкала PI-RADSv2 предназначена для выявления первичного клинически значимого РПЖ до проведения биопсии или после. Большинство экспертов рекомендуют всем пациентам с подозрением на рак простаты (повышение маркеров и/или положительные данные пальцевого ректального исследования) перед биопсией простаты выполнять мпМРТ.
— Предполагается, что с помощью PI-RADSv2 должна быть снижена вариативность методик проведения, интерпретации и заключений мпМРТ, — поясняет И. И. Абдуллин. — Ожидается, что PI-RADSv2 позволит проводить воспроизводимые МРТ-исследования, систематизировать отчеты и унифицировать общение между рентгенологами, урологами и онкологами.
PI-RADSv2 — это уже усовершенствованная версия первой шкалы (PI-RADSv1), которая появилась в 2012 году. Но PI-RADSv1 оставляла возможность субъективности в оценке. Поэтому координационный комитет PI-RADS принял два решения: (1) исключить из протокола исследования МР-спектроскопию, учитывая техническую сложность ее выполнения и наличие данных многоцентровых исследований о ее бесполезности; (2) снизить роль динамической МРТ с контрастированием из-за трудностей в однозначной интерпретации ее результатов.
— По сути, мы не видели первую версию, так что сейчас просто говорим о появлении новой системы, — говорит И. И. Абдуллин в интервью УС.
Несмотря на новизну PI-RADSv2, в литературе уже имеются результаты исследований, показавших ее практичность и эффективность. В мета-анализе 14 исследований (1785 мпМРТ) обобщенная чувствительность и специфичность мпМРТ в диагностике РПЖ составили 78–82 % и 79– 82 % соответственно (Eur Urol, 2015). По данным Greer и соавт. (Radiology, 2017), частота выявления клинически значимого рака в результате биопсии при категории PI-RADS 2 равна 15,7 %; при категории PI-RADS 3 — 33,0 %; при категории PI-RADS 4 — 70,5 %; при категории PI-RADS 5 — 90,7 %.
Эксперты отмечают высокую согласованность в оценке результатов, одинаково высокую чувствительность и специфичность при выявлении образований в периферической и транзиторной зоне.
— Хотя все же и имеются данные о том, что заключения различных экспертов могут отличаться, — продолжает И. И. Абдуллин. — По данным стэнфордского исследования, после проведения мпМРТ у одной группы больных выявляемость PI-RADS 3 варьировала от 3 % до 27%, PIRADS 4 — от 23 % до 65 %, PI-RADS 5 — от 40 % до 80 %. Возможно, такая разнородность чтения мпМРТ связана не только с различиями в квалификации, но и с ограничениями протокола PI-RADS. В нашей клинике оценка результатов мпМРТ проводится консилиумом специалистов лучевой диагностики во главе с ведущим специалистом по лучевой диагностике заболеваний простаты И. А. Трофименко.
В контексте этих данных интересно отметить, что в приведенном выше опросе половина радиологов и урологов отметили, что широкому и рутинному применению PI-RADSv2 мешает неопытность и неосведомленность коллег. Однако оказалось, что большинство специалистов, имеющих претензии к коллегам, работали в неакадемических центрах. Между же урологами и радиологами академических и экспертных центров, рутинно выполняющими мпМРТ и описывающими ее по шкале PI-RADSv2, межэкспертных разногласий не возникает.
Рис. Шкала PI-RADS v2
PI-RADS 3 как серость
“Один из главных недостатков PI-RADS v2 — это отсутствие четких рекомендаций по проведению биопсии, особенно при выявлении PI-RADS 3”, — отмечает Michele Scialpi (Turk J Urol, 2017). Авторы шкалы считают целесообразным проведение биопсии при категории PI-RADS 3 или выше.
При PI-RADS 3 вопрос о назначении биопсии решается с учетом лабораторных данных, результатов пальцевого ректального исследования и анамнеза. Дело в том, что частота выявления рака при биопсии очагов PI-RADS 3 отличается значительной вариабельностью — от 5 % до 26 % (Curr Urol, 2015).
— Выявляемость клинически значимого рака в этих очагах относительно невелика, однако она есть, — отмечает в интервью УС И. И. Абдуллин. — Исходя из нашего опыта, если из очагов PIRADS 3 была выявлена аденокарцинома, то в подавляющем числе случаев был получен суммарный балл по Глисону 6 (3+3) и в незначительном числе 7 (3+4). Поэтому в настоящее время всем пациентам c PIRADS 3 мы рекомендуем фьюжн-биопсию.
Однако есть работы, которые позволяют дифференцировано относиться к этой группе пациентов. Например, D. Junker на 141 пациенте продемонстрировал, что при наблюдении за пациентами с PI-RADS 3 в течение года у 76 % пациентов категория PI-RADS меняется в большую или меньшую сторону. Причем в сторону PI-RADS 4 изменения происходят быстрее. Авторы работы предлагают пациентам с PI-RADS 3 воздержаться от немедленной биопсии и делать ее только если образование будет переквалифицировано в сторону увеличения.
А Michele Scialpi предлагает подразделить PI-RADS 3 на две подгруппы: 3а — опухоли объемом менее 0,5 см 3, которые характеризуются индолентным течением; 3b — опухоли объемом более 0,5 см 3, имеющие высокий риск агрессивного течения. В соответствии с этим предлагается различный алгоритм: при образованиях 3а рекомендуется оставить больного под активным наблюдением с периодическим определением уровня ПСА и повторным выполнением мпМРТ спустя год, а при образованиях 3b предлагается выполнять прицельную биопсию. Вероятно, что такой подход позволит снизить количество необоснованных биопсий.
— Авторы предполагают, что подобное разделение позволит в два раза снизить частоту ненужных биопсий и на 30 % увеличить выявление клинически значимого рака, — продолжает И. И. Абдуллин. — Было бы интересно провести наблюдение за пациентами, разделенными на подгруппы 3a и 3b, как было сделано в исследовании Junker. Это позволит определить, какие очаги более склонны к апгрейду. Я думаю, что в будущем могут появиться и категории 3с, 3d и так далее.
Второсортные режимы?
“Одним из спорных вопросов остается целесообразность применения контрастного режима с гадолинием. Нужен ли он на самом деле? Насколько велики риски, связанные с его использованием, и какова эффективность контрастного исследования, особенно с позиции его стоимости?” — задается вопросом Elmira Hassanzadeh (Abdominal Radiology, 2016).
— Динамическое контрастное усиление при визуализации простаты необходимо для дифференцировки очагов PI-RADS 3 от очагов PI-RADS 4, — отмечает И. И. Абдуллин. — Контрастное усиление не только значительно удлиняет процедуру МРТ, но и увеличивает ее стоимость. Насколько необходимо при каждом МРТ простаты проводить контрастное усиление, остается вопросом.
Если в первой версии системы PI-RADS проводилось изучение всех фаз контрастирования гадолинием вне зависимости от локализации и характера выявленного очагового образования, то в системе PI-RADSv2 режим DCE имеет значение только при оценке очаговых образований периферической зоны, которые изначально оценены как PI-RADS 3 по режиму DWI.
В такой ситуации при гиперконтрастировании образования (DCE +) итоговая категория меняется на PI-RADS 4. И на этом роль динамического МРТ с контрастированием заканчивается. “Режим DCE имеет очень узкую применимость, в связи с чем необходимость его использования следует тщательно изучить”, — считает Elmira Hassanzadeh.
Рис. Отличия двух версий шкал PI-RADS
“Основной причиной “понижения в должности” режима DCE во второй версии системы PI-RADS были данные о малой добавочной пользе его применения. Но, учитывая собственный опыт и данные других исследований, мы посчитали неправомерным полностью отказаться от его использования в рамках рутинно выполняемого мпМРТ”, — отмечают авторы шкалы.
“Несмотря на то, что авторами шкалы подчеркивается второстепенность динамической МРТ с контрастированием, ее выполнение все равно рекомендовано всем пациентам, так как считается, что контрастирование позволяет лучше охарактеризовать образования PI-RADS 3, — отмечает Erik Ruda. — Но на каких исследованиях сформирован данный вывод — остается неясным. Почему бы вместо того, чтобы усложнять технологию МРТ, просто не выполнять прицельную биопсию всем пациентам с PI-RADS 3? Мы считаем, нужно стремиться к упрощению протокола МРТ исследования”.
Авторы шкалы ответили на этот комментарий следующим: “Мы согласны, что для выявления клинически значимого рака предстательной железы режим DWI является ключевым и более информативным, чем режим DCE. Однако в некоторых ситуациях использование DWI для визуализации определенных областей железы может быть технически скомпрометировано “артефактами” исследования. У нас сложилось впечатление, что режим DCE позволяет с большей уверенностью интерпретировать изображения.
К примеру, Vos и соавт. (Eur Urol, 2013) показали, что количественные и полуколичественные параметры DCE на томографе 3Т позволяют разграничивать степень злокачественности очагов (low-grade vs. intermediate-grade vs. high-grade) в периферической зоне. Поэтому мы считаем, что режим DCE позволяет улучшить диагностику образований PI-RADS 3, однако для окончательного суждения нужны исследования”.
Пожалуй, следующим логическим шагом эволюции технологии мпМРТ и шкалы PI-RADS представляется получение ответа на вопрос о роли динамической МРТ с контрастированием. Широкое использование текущего варианта шкалы во множестве центров позволит в будущем при анализе большого количества данных ответить на этот вопрос.
Будущее
В настоящем виде система стандартизованной оценки далека от идеала. Как и другие системы универсальной интерпретации (BI-RADS, LI-RADS и т. д.), шкала PI-RADS остается “живым” документом, который меняется вслед за прогрессом технологий и клинической практики. Andrew Rosenkrantz из New York University Langone Medical Center (Radiology, 2017) выделяет некоторые слабые места шкалы, которые в будущем требуют уточнения или изменения. Во-первых, эксперт отмечает двусмысленность при разделении таких характеристик в режиме DWI, как “малая/средняя выраженность гипоинтенсивности” (PI-RADS 3) и “выраженная гипоинтенсивность” (PI-RADS 4).
Также, по мнению эксперта, в шкале применяются и другие неоднозначные термины: “фокальные изменения”, “затемненные края” и “четко определяемая инвазия”. В приложении к оригинальной статье приводится описание данных терминов и иллюстративный материал, однако на практике даже среди опытных экспертов возникают разногласия в определении данных категорий.
“Составление полноценного атласа с иллюстрациями изменений, подходящих или не подходящих под определенные критерии, также позволило бы снизить вариабельность в экспертных заключениях, — считает Andrew Rosenkrantz. — К тому же, если в исследованиях будет выявляться значительная вариабельность в интерпретации этих терминов, то, возможно, их исключение из следующей версии шкалы PI-RADS будет необходимым и обоснованным”.
Также сложна постановка заключения. Неоднозначна оценка изменений в периферической зоне предстательной железы. Образования этой зоны, которые характеризуются изменениями интенсивности сигнала только на ADC-карте или только на DWI с высоким b-фактором, не соответствуют категории PI-RADS 3 (слабо- или умеренно-выраженные изменения интенсивности на обеих сериях снимков) или PI-RADS 4 (выраженные изменения интенсивности на обеих сериях снимков). Такая неоднозначность может приводить к значительной вариации в заключениях, что также следует учесть в последующих версиях шкалы. Matthew Greer (Radiology, 2017) согласен, что в системе PIRADSv2 имеется относительный перекрест между категориями PI-RADS 2, 3 и 4, что вызывает трудности четкой дифференцировки этих образований.
Другим обсуждаемым вопросом остается необходимость применения не только качественной, но и количественной оценки изменений. Наиболее важным для этой цели представляется вычисление индекса коэффициента диффузии (аpparent diffusion coefficient, ADC). Как пример, на ежегодном конгрессе Международного сообщества по изучению магнитного резонанса в медицине ISMRM для более точного разграничения рака предстательной железы low grade vs. high grade было предложено оценивать среднее значение ADC (ISMRM 24th Annual Meeting; 2016).
К настоящему времени возможности мпМРТ позволяют с большей степенью вероятности выявлять клинически значимый рак в транзиторной зоне предстательной железы, по сравнению с изменениями в периферической зоне. Однако изменения на границе периферической и центральной зон, а также в области передней фибромускулярной стромы чаще всего являются сложными для дифференциальной диагностики.
Заключение
Система унифицированной оценки PIRADSv2 — важнейший компонент внедрения мпМРТ в практику. Она настроена на оптимизацию принципов лечения. Но экспертному сообществу необходимо исправить недостатки существующей системы, которые, возможно, связаны с небольшим опытом ее использования, а также недостаточным пониманием принципов постановки заключения. “Недостаточно было составить систему PIRADS, потребуются скрупулезные образовательные мероприятия, чтобы сделать мпМРТ понятной и клинически значимой”, — отмечают Benjamin Spilseth et al.
— Настало время, когда каждый уролог, занимающийся диагностикой и лечением рака простаты, должен уметь читать мпМРТ, — завершает И. И. Абдуллин.
Да и в целом тренд, отслеживаемый в научной литературе подтверждает, что урологи и онкоурологи должны практически наравне с радиологами “разбираться в картинках”, а не просто потреблять готовые заключения. Так, в текущем году Tzour DT et al. показали, что при пересмотре данных КТ урологи в трети случаев оказались более точными в определении количества и размеров камней. Заключением стал вывод о необходимости совместной оценки КТ радиологами и урологами. Безусловно, при условии, что уролог имеет соответствующую подготовку.
К тому же, как подметили Benjamin Spilseth et al., для одного и того же исследования важен взгляд не только радиолога, расшифровывающего мпМРТ, но и уролога, который эти данные транслирует в клиническую практику.
Список литературы находится в редакции
Вариант исследования мпМРТ
В оригинальной версии протокола PI-RADSv2 не указаны рекомендуемые параметры для проведения исследования. Принципиальные условия — это проведение исследования на томографе мощностью 3Т без применения эндоректальной катушки и без задержки дыхания.