streptococcus mitis что это такое у ребенка
Зеленящие стрептококки
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику. Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae. Эта группа является очень важным компонентом в составе нормально микрофлоры полости рта, слизистых оболочек дыхательных путей, пищеварительного тракта и половых органов. Поэтому обнаружив следующих ее представителей (S.gordonii, S.oralis, S. mutants, S.sanguis и S.salivarius) в посеве из полости рта, не надо немедленно начинать это лечить – этим вы только навредите организму, выбив из его состава важный компонент его нормальной микрофлоры.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
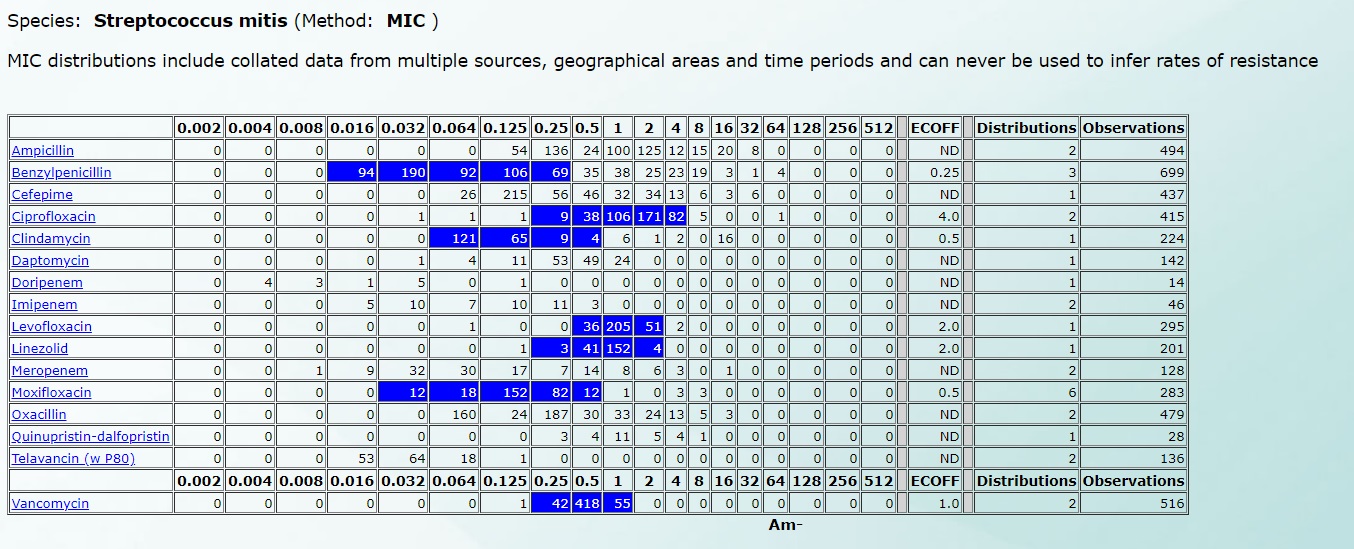
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
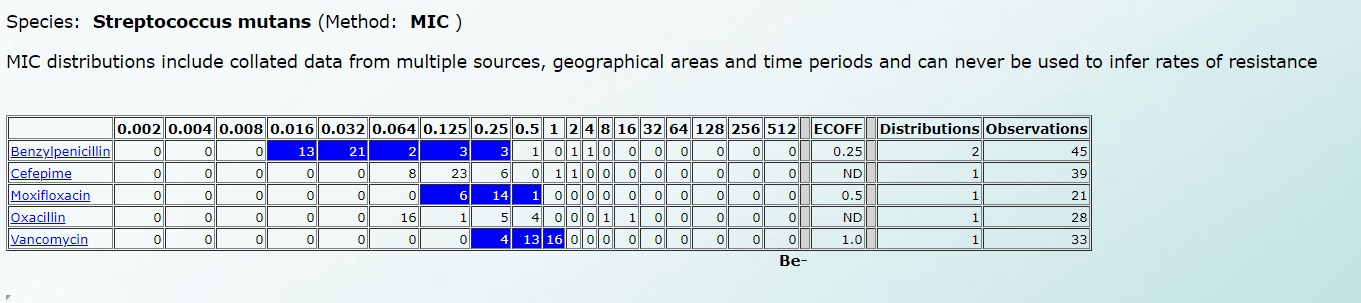
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.
Стрептококковая инфекция группы В у новорожденных и грудных детей
Рассмотрены клинические проявления и исходы стрептококковой инфекции группы В (СГБ) у новорожденных, методы диагностики СГБ-инфекции, подходы к лечению и провилактике.
Clinical manifestations and clinical outcome of streptococcosis of B group, methods of streptococcosis of B group diagnostic, approaches to treatment and prophylaxis are covered.
Стрептококк группы В (S. agalactiae) является наиболее частой причиной заболеваемости и смертности новорожденных детей от менингита, сепсиса и пневмонии в развитых странах [1]. В США ежегодно заболевают тяжелой стрептококковой инфекцией группы В 8000 новорожденных, около 800 этих детей умирает. В Великобритании частота ранних неонатальных инфекций, вызванных стрептококком группы В (СГБ), составляет 3,6 случая на 1000 новорожденных [2]. Регистрация и профилактика СГБ-инфекции у беременных и новорожденных проводится во многих странах (США, Канада, Австралия, Бельгия, Франция и др.), что позволило радикально снизить частоту заболеваемости и летальность от данной инфекции у новорожденных. С введением в развитых странах антибиотикопрофилактики СГБ-инфекции в родах, частота развития менингита у детей в период с 1993 по 2008 год сократилась на 80 процентов [1]. В России мероприятия по регистрации и профилактике инфекций, вызванных СГБ, не проводятся.
Клинический случай. Ребенок (девочка) от первой беременности, протекавшей на фоне гестоза с 4-кратной угрозой прерывания. У матери во время беременности было обострение хронического пиелонефрита. Роды преждевременные на сроке 35–36 недель путем кесарева сечения. Масса тела при рождении 2650 г. Заболела в возрасте 24 дня: вялость, субфебрилитет, отказ от еды, срыгивания, жидкий стул 3–5 раз в день. На 4-й день болезни состояние резко ухудшилось, и девочка госпитализирована в инфекционный стационар. При поступлении состояние крайне тяжелое: среднемозговая кома, выбухание и пульсация большого родничка, частые приступы тонических судорог, дыхание аритимичное, ослабление дыхания в нижних отделах легких, мраморность кожи, акроцианоз, тахикардия до 190 уд./мин, «кофейная гуща» из желудка, олигурия. В общем анализе крови: Ley 21400, Tr 36000, п — 4%, с — 56%, э — 0%, б — 6%, л — 24%, м — 13%, t сверт. 9 мин, СОЭ 23 мм/ч. Результаты исследования ликвора: ликвор желтый, мутный, pH = 7,0, реакция Панди ++++, реакция Нонне-Апельта ++++, цитоз 34 тыс. клеток в 1 мкл (нейтрофилы 89%, лимфоциты 11%), белок 2,98 г/л, глюкоза 3,8 ммоль/л. В биохимическом анализе крови выявлена умеренная гипербилирубинемия и гиперферментемия, снижение протромбинового индекса (ПТИ) до 40%, декомпенсированный метаболический ацидоз (рН 6,8; ВЕ — 27,3 ммоль/л). Результаты бактериологического исследования крови и ликвора отрицательные. Положительный латекс-тест на антиген S. agalactiaе в ликворе. Исследования фекалий на ротавирус, патогенные и условно-патогенные микроорганизмы отрицательные. Заключительный диагноз: поздний неонатальный сепсис, вызванный S. agalactiae (менингоэнцефалит, кардит, энтероколит, пневмония, гепатит). Осложнения: полиорганная недостаточность. Септический шок II–III стадии. Отек-набухание головного мозга. Диссеминированное внутрисосудистое свертывание (ДВС-синдром) III стадии. Ребенок получил 4 курса антибактериальной терапии (ампициллин, цефтриаксон, меронем, амикацин, ванкомицин), посиндромную терапию. Выписана в удовлетворительном состоянии на 27-й день болезни.
Источник СГБ-инфекции и риск заболевания у ребенка
СГБ являются представителями нормальной микрофлоры урогенитального, кишечного тракта и верхних дыхательных путей человека. СГБ обнаруживаются в составе микрофлоры влагалища у 15–45% женщин [3]. Преобладает бессимптомная колонизация (носительство), но СГБ может стать причиной развития у женщины инфекции мочевых путей, сепсиса, хориоамнионита, эндометрита, тромбофлебита и эндокардита. Наиболее высок уровень колонизации у женщин моложе 20 лет, ведущих активную половую жизнь, использующих ВМС-контрацепцию [4]. Беременность не влияет на частоту носительства СГБ.
По нашим данным частота носительства S. agalactiaе в урогенитальном тракте у женщин репродуктивного возраста г. Казани составляет 12,7%. Результаты получены при бактериологическом исследовании мазков из цервикального канала, слизистой влагалища, мочи 172 женщин с использованием полихромогенной среды с последующей идентификацией микроорганизмов на анализаторе VITEK. Не исключается, что частота носительства СГБ выше, поскольку не проводилось бактериологическое исследование ректальных мазков.
Основным источником инфицирования новорожденных детей СГБ является мать [4]. Инфицирование ребенка может произойти внутриутробно, а также в родах. Родоразрешение путем кесарева сечения не снижает риск инфицирования ребенка СГБ. Вертикальный путь передачи СГБ в основном приводит к развитию ранней стрептококковой инфекции (срок развития до 7-го дня жизни). Основными факторами риска развития СГБ-инфекции у новорожденных являются: бактериурия S. agalactiae у матери во время беременности, неонатальные СГБ-инфекции у ранее рожденных детей, недоношенность (
И. В. Николаева, кандидат медицинских наук, доцент
Казанский государственный медицинский университет, Казань
Стрептококковая инфекция
Стрептококковая инфекция — инфекционные заболевания, вызываемые стрептококками, преимущественно β-гемолитическими группы А (СГА).
Стрептококки группы А могут вызывать заболевания (скарлатина, рожа) и местные воспалительные процессы с локализацией в различных органах и системах организма (кожа, суставы, сердце, мочевыделительная, дыхательная системы и др.).
В настоящее время известно 83 серологических типа СГА. Считается, что один и тот же серотип стрептококка способен вызвать как носительство, так и любое заболевание.
Стрептококки способны продуцировать ряд токсинов и ферментов агрессии, наличие и уровень активности которых определяют индивидуальную вирулентность каждого отдельного штамма возбудителя.
Вот только некоторые из них:
1. Токсин эритрогенин оказывает на организм наибольшее воздействие:
2. Стрептолизин S оказывает на организм иммуносупрессорное (подавляющее) действие.
Стрептококки высокоустойчивы к физическим воздействиям, хорошо переносят замораживание, в высохшем гное способны сохраняться неделями и месяцами, но быстро погибают под действием дезинфицирующих средств и антибиотиков, особенно пенициллина.
Вот такая интересная инфекция, особенно если вспомнить, что сейчас осень и мы все, и в большей степени дети, подвержены различным простудным заболеваниям, а стрептококки не дремлют.
Чем же он так страшен? Почему его так боятся?
Источник инфекции — человек, больной любой формой стрептококковой инфекции, а также носитель патогенных штаммов стрептококка.
В эпидемическом отношении наиболее опасными являются дети с поражением носа, ротоглотки и бронхов (скарлатина, ангина, назофарингит, бронхит), особенно посещающие детские сады и школы.
Большую роль в распространении инфекции играют пациенты с легкими, атипичными формами стрептококковых заболеваний (типа «немного болит горло»), а также носители стрептококка, имеющие хронические заболевания (аденоидиты, тонзиллиты, фарингиты и др.).
Основной путь передачи — воздушно-капельный. Интенсивность распространения стрептококка значительно возрастает при ОРВИ (кашель, чихание).
У детей раннего возраста возможен контактно-бытовой путь — через инфицированные игрушки, предметы ухода, руки ухаживающего персонала.
Пищевой путь — через продукты (молоко, сметана, творог, кремы), в которых стрептококки быстро размножаются, может приводить к возникновению вспышек стрептококковых заболеваний, характеризующихся чертами, присущими пищевым токсикоинфекциям.
Восприимчивость к стрептококку высокая. В различных возрастных группах преобладают определенные клинические формы стрептококковой инфекции.
У новорожденных и детей первых месяцев жизни в связи с наличием антитоксического иммунитета, приобретенного от матери, практически не встречается скарлатина, но наблюдаются различные гнойно-воспалительные заболевания (отит, стрептодермия, лимфаденит, остеомиелит и др.).
В более старших возрастных группах чаще встречается скарлатина и относительно реже — гнойно-септические процессы.
Заболевания которые может вызвать стрептококк
Скарлатина является наиболее распространенной формой стрептококковой инфекции у детей.
На современном этапе скарлатина в большинстве случаев протекает в легкой форме, что приводит к поздней диагностике, частым диагностическим ошибкам, несвоевременному лечению.
Дети, посещающие детские учреждения, заболевают в 3-4 раза чаще детей, воспитывающихся дома. В этой же группе отмечают более высокие показатели «здорового» бактерионосительства.
Проявления заболевания
Характерная алая сыпь, возникающая при скарлатине, — это реакция организма на эритротоксин, который с первого дня развития болезни вырабатывается стрептококка при размножении на слизистых поверхностях. Под воздействием этого токсина мелкие кровеносные сосуды расширяются, образуя пятна красного цвета и округлой формы.
Сочетание ангины и красной сыпи, постепенно захватывающей поверхности тела, начиная с головы и спускаясь вниз, позволяет уверенно диагностировать данное заболевание при внешнем осмотре.
К специфическим симптомам относят также отсутствие сыпи в области носогубного треугольника, что, вместе с выраженной гипертермией, покраснением щек и одутловатостью шеи из-за увеличения шейных лимфатических узлов составляет характерную картину внешности заболевшего ребенка.
Инкубационный период от момента заражения до появления явных симптомов составляет в среднем 5-7 дней, но известны случаи, когда скрытый этап длился от нескольких часов до 12 дней. При этом заболевший скарлатиной ребенок заразен с первого же дня до клинического выздоровления, то есть в течение примерно трех недель.
Ранние осложнения скарлатины у детей
Как правило, возникновение осложнений раннего и позднего периода связано с несвоевременной диагностикой или недостаточностью терапии заболевания.
Лечение скарлатины требует четкого соблюдения всех назначений специалиста не только для быстрого и эффективного выздоровления, но и для предотвращения развития многочисленных и достаточно серьезных осложнений данной инфекции.
При внедрении в организм инфекционный агент начинает негативно воздействовать на различные органы и системы. К наиболее распространенным осложнениям раннего периода скарлатины у детей относят такие явления, как:
Данные осложнения развиваются при заболевании скарлатиной ослабленным ребенком или при несвоевременном начале терапии, приводящим к тяжелой форме скарлатины. Поэтому так важно вовремя обратиться к врачу, чтобы был установлен правильный диагноз.
Поздние осложнения скарлатины
Большинство поздних осложнений при заболевании скарлатиной связаны с несвоевременным начало лечения и несоблюдением назначений в режиме и ограничении нагрузок во период заболевания и восстановления.
1. Суставной ревматизм
Первые симптомы отмечаются в среднем спустя две недели после клинического выздоровления и включают следующие проявления:
Воспаление развивается при проникновении стрептококка в сердечную мышцу. Для излечения миокардита необходимо устранение причины заболевания, что подразумевает полноценное лечение скарлатины.
Для уменьшения вероятности возникновения миокардита в период заболевания и в течение двух недель после выздоровления необходимо ограничивать физическую нагрузку. Поэтому скарлатина у детей требует освобождения от уроков физкультуры на срок от двух недель и соблюдение постельного режима в процессе лечения скарлатины.
Проявления гломерулонефрита могут отмечаться как через несколько дней, так и спустя несколько недель после заболевания скарлатиной.
В начале болезни проявляются следующие признаки:
В 5% случаев поздним осложнением скарлатины является воспаление легких. Стрептококковая пневмония развивается на первой неделе заболевания скарлатиной септической формы из-за попадания стрептококков в легкие по дыхательным путям.
Если воспаление легких отмечается позднее, то обычно возбудителем является пневмококк, присоединяющийся на фоне ослабленного иммунитета организма ребенка.
Вот такая бы казалась детская инфекция, которая приводит к таким серьезным осложнениям в здоровье.
Принципы лечения скарлатины в детском возрасте
При диагностике скарлатины лечение определяется врачом. В первую очередь выбор терапии основывается на форме заболевания, тяжести его течения и сопутствующих болезнях, дисфункциях и индивидуальных особенностях ребенка.
Легкая форма не всегда требует назначения антибиотиков, необходимость антибиотикотерапии определяется педиатром.
В обязательную поддерживающую терапию, направленную на облегчение симптоматики и снижение вероятности развития осложнений, включают препараты противовоспалительного действия для носоглотки, жаропонижающее, если есть такая необходимость. Обязательным условием является обильное питье, а также соблюдение постельного режима больного, отсутствие нагрузок, покой, диетическое питание.
Средняя и тяжелая формы заболевания скарлатиной излечиваются антибиотиками пенициллиновой группы, наиболее эффективной против стрептококков.
Если при установленном диагнозе скарлатины лечение антибиотиками пенициллинового ряда невозможно (например, при наличии аллергической реакции к пенициллину), подбираются препараты других групп, к которым установлена чувствительность стрептококка.
В дополнение к обязательной антибиотикотерапии назначаются жаропонижающие средства, препараты для дезинтоксикации организма, витамины. При присоединении осложнений подбирается соответствующий курс лечения.
Лечением скарлатины занимается врач-педиатр, самостоятельные назначения препаратов недопустимы.
При любой форме заболевания скарлатиной необходимо обильное питье для вывода эритотоксинов и облегчения состояния больного, а также постельный режим и полный покой пациента.
Следует помнить, что скарлатина в легкой форме при несоблюдении назначений врача может стать причиной серьезных осложнений, приводящих к хроническим заболеваниям или инвалидизации ребенка.
Стрептококк профилактика
Скарлатина — болезнь, пока не поддающаяся профилактике методами вакцинации. Поэтому, чтобы избежать заболевания скарлатиной, проводятся меры неспецифической профилактики, препятствующие распространению инфекции в детских коллективах.
Поэтому при диагностике скарлатины у ребенка, посещающего дошкольное или школьное образовательное учреждение в классе или группе детского сада, устанавливается недельный карантин. При наличии контакта с заболевшим скарлатиной ребенком других детей допускают в коллектив только через 17 дней при отсутствии симптомов начала болезни.
Тем, кто перенес скарлатину дома, разрешается посещение детского учреждения спустя 22 дня от первого дня болезни, а выписанным из стационара — через 12 дней с момента выписки.
Такие карантинные меры помогают снизить процент заболеваемости и предотвратить эпидемии в детских садах, школах и иных формах детских коллективов.
Соблюдение личной гигиены также является одним из методов профилактики заболевания скарлатиной.
1. Обязательное мытье рук с мылом в течение 30 секунд, тщательная их обработка, особенно по возвращении из мест скопления людей, регулярная санитарная обработка игрушек, предметов, поверхностей, мытье продуктов питания позволяют эффективно уничтожать большинство болезнетворных микроорганизмов.
2. В доме, где находится больной скарлатиной, проводят особые гигиенические мероприятия, включающие регулярную обработку поверхностей хлорамином, кипячение постельного, нательного белья и посуды, антисептическую обработку игрушек.
3. При контакте с больным скарлатиной рекомендуется регулярное полоскание горла антисептиком, особенно при наличии хронических заболеваний носоглотки (фарингит, тонзиллит, гайморит и т. п.), промывание носовых ходов солевым раствором.
Факты о стрептококковой инфекции
Обзор составлен на основе обзора Федеральных клинических рекомендации от апреля 2015 года.
По данным ВОЗ стрептококковая инфекция признается самой опасной из всех предупреждаемых вакцинопрофилактикой болезней.
Стрептококки — это бактерии, которые вызывают отиты, бронхиты, пневмонию, менингиты, сепсис.
В России из 500 тысяч случаев пневмоний в год пневмококковую этиологию имеют 76% у взрослых и до 90% у детей в возрасте до 5-ти лет!
При обследовании детей в возрасте до 5-ти лет, госпитализированных в стационары по поводу острой бактериальной инфекции (сепсис, бактериемия, менингит, пневмония, острый отит, синусит), при посевах образцов в 47% случаев был выявлен S.pneumoniae («стрептококк пневмония»), что подтверждает его лидирующую роль в структуре инфекционных заболеваний.
Носительство стрептококка в носоглотке в большинстве случаев протекает бессимптомно, однако у детей первых лет жизни может сопровождаться насморком.
К сожалению, в настоящее время формируется большое количество антибиотикоустойчивых форм стрептококка.
Согласно позиции ВОЗ — единственный способ существенно повлиять на заболеваемость и смертность от стрептококковой инфекции, снижение уровня антибиотикорезистентности.
В настоящее время в России вакцинация против стрептококк пневмония проводится 3-мя препаратами — Превенар, Пневмовакс 23, Синфлорикс. Какой препарат наиболее подходящий для конкретного случая — подробнее подскажет врач-педиатр на приеме.
В настоящее время вакцинация проводится, начиная с 2-х месячного возраста и до глубокой старости.
Наиболее актуальна вакцинация для:
Университет
БГСА вызывает различные варианты инфекции: поверхностные (фарингит, тонзиллофарингит, стрептодермия, рожа), инвазивные (некротизирующий фасциит или миозит, эндокардит, сепсис), токсин-опосредованные (скарлатина, синдром стрептококкового токсического шока); провоцирует развитие иммунно-опосредованных заболеваний у предрасположенных лиц (острый гломерулонефрит, острая ревматическая лихорадка (ОРЛ), постстрептококковый артрит, синдром PANDAS).
Наиболее частая клиническая форма БГСА-инфекции — ОТФ, т. е. острое воспаление лимфоидных образований глоточного кольца (чаще всего небных миндалин) и слизистой оболочки глотки, что имеет место примерно у 30 % всех детей с экссудативными тонзиллитами. Большинство случаев ОТФ у детей и взрослых вызваны вирусами (адено-, рино-, коронавирусы, вирусы гриппа, парагриппа, Эпштейна — Барр, Коксаки и т. д.). Это принципиально важно, т. к. вирусные ОТФ не требуют назначения антибактериальной терапии (АБТ).
В Международной классификации болезней Х пересмотра выделяют «Стрептококковый тонзиллит» (J03.0) и «Стрептококковый фарингит» (J02.0). В зарубежной литературе обычно используется термин «тонзиллофарингит» (считается, что изолированное воспаление этих структур ротоглотки как единого целого невозможно и говорит лишь о преимущественном поражении той или другой).
При диагностике и лечении стрептококковых ОТФ возникает ряд принципиальных вопросов. К сожалению, клинически и фарингоскопически отличить острый вирусный тонзиллит от БГСА непросто. Для стрептококкового ОТФ характерно отсутствие кашля, ринита, конъюнктивита, отмечаются выраженное увеличение и болезненность лимфоузлов в области угла нижней челюсти, насыщенная гиперемия мягкого неба и язычка, часто с петехиями, падение температуры через 12–24 часа после начала АБТ. Что касается налетов на миндалинах, то они с одинаковой частотой присутствуют и при вирусных тонзиллитах, особенно аденовирусной и ВЭБ-инфекции, и при стрептококковой инфекции. Однако при стрептококковых тонзиллитах налеты появляются в первые сутки болезни, а при вирусных обычно на 3–4-й день.
Для более эффективной клинической дифференциальной диагностики вирусного и стрептококкового тонзиллофарингита предложено использовать шкалы R. M. Centor и W. McIsaac (1998). Первая предназначена как для детей, так и для взрослых. По ней оценивают: температуру тела выше 38 °С, отсутствие кашля, увеличение и болезненность шейных лимфатических узлов, отечность миндалин, а также возраст больного (см. табл. 1). Чем выше сумма баллов, тем вероятнее риск БГСА-тонзиллита. Но даже при максимальной оценке по этой шкале вероятность выделения БГСА составляет всего 51–53 %. Несмотря на это детям с оценкой ≥ 3 баллов рекомендовано незамедлительно назначать АБТ из-за риска развития осложнений (см. табл. 2).
Бактериологическое исследование считается «золотым стандартом» диагностики, его чувствительность превышает 90 %, а специфичность 95–99 %. Основной недостаток — длительность (не менее 24–48 часов в случае выявления БГСА). Возможно получение ложноотрицательных результатов посевов по нескольким причинам. Во-первых, выделение стрептококков затруднено в тех случаях, когда наряду с ними в материале встречаются гемолитические стафилококки (Staphylococcus aureus), которые отличаются бурным ростом и «забивают» колонии стрептококков.
Во-вторых, культуральными методами не выделяются стрептококки, персистирующие внутриклеточно, что характерно для хронических тонзиллитов и после неадекватной АБТ. Для их выделения необходимы специальные микробиологические методы. В-третьих, во многих лабораториях для посева микроорганизмов используются питательные среды с добавлением донорской крови, а донорская кровь может содержать антитела к БГСА, которые препятствуют росту этих микроорганизмов. Важно помнить, что использование на амбулаторном этапе антибиотиков (даже их однократный прием) резко уменьшает вероятность выделения возбудителя бактериологическим методом.
В настоящее время широкое распространение получили методы экспресс-диагностики стрептококкового антигена в мазках с поверхности миндалин и/или задней стенки глотки (Streptatest, STREP-A-CHECK-1, Binax-Strep A), которые позволяют получать результат уже через 15–20 минут. Однако несмотря на высокую специфичность (95–100 %), они характеризуются более низкой чувствительностью (60–80 %), чем культуральное исследование.
Однако ни культуральное исследование, ни экспресс-тесты не позволяют дифференцировать больных с ОТФ стрептококковой этиологии от бессимптомных носителей БГСА с интеркуррентной вирусной инфекцией.
В соответствии с рекомендациями ESCMID (Европейского общества по клинической микробиологии и инфекционным заболеваниям) 2012 года культуральное исследование мазка на БГСА не рекомендуется как рутинное у всех пациентов с острой болью в горле. При высокой вероятности БГСА на основании оценки по клиническим шкалам следует по возможности провести экспресс-диагностику, в случае отрицательного результата экспресс-теста бактериологическое исследование не проводится.
IDSA (Американское общество специалистов по инфекционным болезням) рекомендует более широкое использование экспресс-теста и (или) культурального исследования мазка с задней стенки глотки, поскольку клинические симптомы не считаются надежными критериями при дифференциальной диагностике ОТФ, вызванного вирусами и БГСА, кроме случаев, когда выражены симптомы вирусной инфекции (насморк, кашель, осиплость голоса и/или язвенные поражения слизистой оболочки полости рта).
У детей и подростков отрицательные результаты экспресс-теста должны быть подтверждены культуральным исследованием (у взрослых необязательно в связи с низкой распространенностью БГСА-инфекции и крайне низким риском развития ревматической лихорадки в последующем). При положительном экспресс-тесте культуральное исследование нецелесообразно. У детей младше 3 лет классические стрептококковые ОТФ практически не встречаются, а обследование на БГСА в этой возрастной группе показано только, если она диагностирована у брата или сестры.
Лабораторные данные также не всегда позволяют отличить бактериальную инфекцию от вирусной. Маркерами бактериальной инфекции можно считать лейкоцитоз более 15 х 109/л, нейтрофилез более 10 х 109/л и/или палочкоядерных форм более 10 % или более 1,5 х 109/л, СРБ более 70 мг/л. Более низкие цифры или значительное повышение только одного из этих показателей нередко встречаются при вирусных инфекциях. Так у 1/3 детей с тонзиллитами, вызванными аденовирусами и вирусом Эпштейна — Барр, лейкоцитоз превышает 15 х 109/л, а СРБ 60 мг/л. С другой стороны, низкие цифры маркеров не обязательно позволяют исключить бактериальную инфекцию. Таким образом, лабораторные маркеры воспаления не всегда помогают в диагностике стрептококковой инфекции, их диагностическая ценность ниже, чем у катаральных симптомов, и рутинное исследование биохимического анализа крови при ОТФ не рекомендуется.
Серологическая диагностика БГСА-инфекции получила широкое распространение. Чаще всего в общеклинических лабораториях она ограничивается определением титра антител к стрептолизину О (АСЛ-О). Истинные БГСА-инфекции всегда вызывают специфический иммунный ответ — нарастание титра АСЛ-О. Определение АСЛ-О в венозной крови является высоко чувствительной и специфичной (около 80 %) реакцией, определение АСЛ-О в капиллярной крови значительно менее достоверно.
Синтез антител вообще и АСЛ-О в частности зависит от индивидуальных особенностей иммунного ответа: у одних он выраженный и длительный, у других замедленный. Синтез антител стартует через 1–2 недели от начала стрептококковой инфекции, но даже спустя 8 недель после перенесенного БГСА-тонзиллофарингита титр АСЛ-О может не достигать максимума. АСЛ-О способен сохраняться на очень высоком уровне до года.
Величина АСЛ-О в острый период не дает никакого представления о риске развития иммунных осложнений и не зависит от тяжести болезни. С другой стороны, если у больного уже в первые трое суток от начала тонзиллофарингита АСЛ-О повышен, это исключает острую стрептококковую инфекцию и говорит о том, что пациент перенес ее в сроки от 2 недель до 6–12 месяцев до обследования или страдает хроническим тонзиллитом. Иммунные осложнения (гломерулонефрит, ОРЛ) развиваются спустя 3–8 недель после БГСА-инфекции; если они не возникли в эти сроки, то вряд ли можно предполагать их развитие в дальнейшем (даже несмотря на повышенный уровень АСЛ-О).
Нужно четко понимать, что АСЛ-О представляют собой антитела распознавания антигена, а не его элиминации, и не лечить пациента антибиотиками, добиваясь нормализации этого показателя. Иммунный процесс имеет определенную стадийность, которая развивается, несмотря на гибель патогена. Лечить нужно инфекцию, а не повышенный уровень АСЛ-О! Определение титра АСЛ-О рекомендовано лишь в кардиоревматологии, нефрологии для доказательства стрептококковой этиологии поражения сердца и почек.
Для диагностики стрептококковой этиологии ОТФ определение уровня антител не используется, диагноз верифицируется культуральными методами. Этот тест может использоваться для дифференцировки активной инфекции от состояния носительства. (Достаточно подробно значение определения АСЛ-О описал Александр Лавринович в «МВ» от 5 января 2017 года).
Различают ранние и поздние (иммунные) осложнения БГСА-инфекции.
Ранние осложнения представлены шейным лимфаденитом, паратонзиллитом, парафарингитом, заглоточным и перитонзиллярным абсцессами. Этиология этих осложнений связана с сочетанной флорой (БГСА и анаэробы), проникающей в паратонзиллярную клетчатку и лимфоузлы из глубины лакун при тяжелом тонзиллите или вследствие травмы, например при обработке, тушировании миндалин. При этом у больного, несмотря на проводимое лечение, сохраняется лихорадка, боли при глотании, поворотах головы, открывании рта. При осмотре выявляются асимметрия зева, выбухание стенки глотки.
Иммунные осложнения БГСА-инфекции, к которым относятся постстрептококковый острый гломерулонефрит и острая ревматическая лихорадка, хорошо известны клиницистам. Последнее заболевание развивается у 0,3 % больных с нелеченным БГСА-тонзиллитом, из них у 40 % формируется хроническая ревматическая болезнь сердца. Адекватная АБТ на 80 % снижает риск развития острой ревматической лихорадки (ОРЛ), на 85 % — паратонзиллярного абсцесса.
Так называемые ревматогенные штаммы БГСА обладают рядом определенных свойств. Особое значение имеет М-протеин — типоспецифический антиген, располагающийся в наружном слое клеточной стенки. Антитела к М-протеину перекрестно реагируют с различными тканями организма-хозяина по принципу молекулярной мимикрии как основного патогенетического механизма развития иммунных осложнений БГСА-инфекции. Кроме того, белок М обладает свойствами суперантигена, вызывая поликлональную активацию лимфоцитов и образование низкоаффинных антител, что может привести к нарушению толерантности к собственным тканевым антигенам и развитию аутоагрессии, особенно у генетически предрасположенных больных. Эти свойства отмечены у серотипов М-3, М-5 и М-18.
Иммунопатологические осложнения БГСА-инфекции развиваются в стадии реконвалесценции. Острый гломерулонефрит манифестирует на 7–10-й день болезни, причем адекватная терапия ангины не снижает риска его развития. Клиника ОРЛ появляется через 2–3 недели после купирования симптомов ОТФ, причем лихорадка бывает не более чем у 30 % больных. Однако и в острый период ОТФ выявляются нарушения со стороны внутренних органов. Изменения со стороны сердечно-сосудистой системы характеризуются тахикардией, приглушенностью или ослаблением сердечных тонов.
При нормализации температуры тела тахикардия сменяется брадикардией, глухость сердечных тонов становится еще более выраженной. У 1/3 больных в острой стадии болезни выявляется микрогематурия, исчезающая при купировании синдрома интоксикации. Эти патологические изменения связаны с прямым действием токсинов стрептококка (экзотоксины, стрептокиназа, гиалуронидаза и др.) на органы, не имеют отношения к иммунопатологическим реакциям и не требуют проведения какой-либо противовоспалительной или иммуносупрессивной терапии.
Осложенные БГСА-инфекции
В последние годы появляется все больше сообщений о постстрептококковых аутоиммунных заболеваниях центральной нервной системы. Спектр их достаточно широк и включает в себя тики и обсессивно-компульсивные состояния. Малая хорея, которая развивается у 15 % детей после БГСА-инфекции, рассматривается как один из критериев острой респираторной лихорадки (ОРЛ), но может протекать и как изолированная патология. Характерны дистонии, паркинсонизм, а также психические нарушения и расстройства сна. Особенно часто эти осложнения БГСА-инфекции встречаются в детском возрасте, в связи с чем выделены в особую группу PANDAS (Pediatric autoimmune neuropsychiatric disorders associated with streptococcal infections — детские аутоиммунные нейропсихические расстройства, связанные со стрептококковой инфекцией). Патогенетический механизм нейродисфункции опосредован антителами к нейропротеинам по принципу антигенной мимикрии. Аутоиммунный характер этих заболеваний еще только изучается, тем не менее о нем говорит значительное улучшение психоневрологического состояния после тонзиллэктомии.
С 1990-х годов в США и Западной Европе регистрируются случаи чрезвычайно тяжелой инвазивной БГСА-инфекции, протекающей с гипотензией, коагулопатией и полиорганной недостаточностью (обозначается как синдром стрептококкового токсического шока — по аналогии со стафилококковым токсическим шоком, но со значительно более высоким уровнем летальности). Входными воротами для этой угрожающей жизни формы БГСА-инфекции служат кожа и мягкие ткани, однако в 10–15 % случаев заболевание ассоциируется с первичным очагом в лимфоидных структурах носоглотки.
Применение антибиотиков
Основной метод лечения БГСА-инфекции — системная антибиотикотерапия (АБТ), местная терапия носит вспомогательный характер. Цель — не только ликвидация клинических проявлений болезни, но и эрадикация БГСА из ротоглотки, что предотвращает распространение возбудителя и предупреждает развитие осложнений. Однако даже в случае отсутствия АБТ стрептококковый острый тонзиллофарингит (ОТФ) является саморазрешающимся в течение нескольких дней заболеванием. Сохранение симптомов более длительное время означает развитие гнойных осложнений или хронического носительства БГСА.
Стрептококки вообще и БГСА в частности являются исключением из всех клинически значимых микроорганизмов, поскольку не способны к выработке β-лактамаз. β-лактамные антибиотики остаются единственным классом препаратов, к которому у стрептококков не развилась устойчивость. В отличие от других стрептококков, БГСА не обладает способностью к модификации мишени действия для β-лактамов, поэтому повышение стандартных доз пенициллинов не требуется.
Частота клинической и микробиологической неэффективности пенициллинотерапии составляет 24–30 %. В качестве возможных причин могут выступать:
Низкая приверженность лечению. Поскольку на 3–4-е сутки АБТ симптомы болезни исчезают, большинство пациентов прекращают лечение. По некоторым данным, при назначении стандартной 10-дневной схемы пенициллинотерапии, на 9-е сутки продолжали прием препарата только 8 % больных. Несоблюдение сроков лечения пенициллином БГСА-инфекции может быть также одной из причин развития ОРЛ (в 10–15 % случаев).
Гидролиз пенициллина и амоксициллина β-лактамазами, которые продуцируются флорой, присутствующей в ротовой полости. У здоровых лиц миндалины в норме колонизированы ротоглоточной микрофлорой, представляющей приблизительно 200 видов микробов-комменсалов. Широкое применение АБТ (особенно при наличии хронического тонзиллита) приводит к тому, что состав флоры ротоглотки претерпевает изменения, при которых увеличивается количество штаммов бактерий, продуцирующих β-лактамазы.
Коагрегация, т. е. образование микробных сообществ (биопленок) благодаря адгезинам, синтезируемым ко-патогенами из предыдущего пункта. Уязвимость микроорганизмов в биопленке со стороны антибиотиков и иммунной системы резко снижается. Появление биопленок может рассматриваться как одно из показаний к тонзиллэктомии и ведущая причина хронического воспаления небных миндалин (хронического тонзиллита), особенно при наличии их гипертрофии.
Реинфицирование БГСА. Риск реинфекции особенно велик в закрытых и полузакрытых коллективах (детские сады, школы, детские дома и т. д.). Реинфекция может развиться при контакте с носителем БГСА (особенно если клинические симптомы у него отсутствуют), контаминированными предметами.
Недостаточное проникновение антибиотиков в ткань миндалин (может быть связано с конкретным препаратом либо cо склеротическими изменениями миндалин на фоне повторных ангин). В настоящее время показано, что макролиды и цефалоспорины создают сравнительно бóльшие тканевые концентрации, чем пенициллин.
In vitro обнаружена способность некоторых штаммов БГСА к внутриклеточному паразитированию в макрофагах и эпителиальных клетках дыхательных путей. Антибиотики, не обладающие способностью к внутриклеточному накоплению (все β-лактамы), не влияют на эти формы патогенов. Однако наличие таких штаммов in vivo не доказано.
Ложное рецидивирование: ОРВИ у носителей БГСА сопровождается положительными результатами бактериологического исследования, такие пациенты многократно проводят АБТ. Рекомендуется использовать клинические шкалы вероятности БГСА-инфекции перед назначением посевов, а также учитывать сроки наступления эффекта от АБТ: при БГСА-инфекции купирование лихорадки и болевого синдрома происходит через 12–48 часов, а то время как при ОРВИ средняя длительность лихорадки составляет 3–5 дней независимо от терапии. Однако при назначении АБТ на 2–3-й день ОРВИ возможна имитация положительного эффекта в связи с совпадением ожидаемого срока действия препарата с саморазрешением ОРВИ.
Все антибактериальные препараты, за исключением однократного назначения бензатина бензилпенициллина и 5-дневного курса азитромицина, должны применяться в течение 10 дней (см. табл. 1). Проведение бициллинопрофилактики у больных острым БГСА-тонзиллитом, получивших полный курс АБТ, считается необоснованным (вероятность сохранения носительства стрептококка крайне мала). Бициллин после адекватно пролеченной ангины назначают только детям с ревматической болезнью в рамках вторичной профилактики.
Лечение хронического рецидивирующего тонзиллита отличается от лечения острых форм из-за сопутствующей микрофлоры (см. табл. 2).
Носителям БГСА терапия антибиотиками не проводится, за исключением детей из закрытых коллективов: в этих случаях рекомендуется использовать клиндамицин или цефалоспорины (их способность к эрадикации данного возбудителя у носителей оказалась достоверно выше).
Рутинное культуральное исследование после окончания лечения не проводится, кроме особых обстоятельств: пациенты с высоким наследственным риском развития ОРЛ и пациенты с рецидивирующими эпизодами стрептококкового ОТФ. До 7–37 % больных, получавших адекватную АБТ, имеют положительный экспресс-тест или результат культурального исследования, что связано с носительством БГСА. Обследование и АБТ у бессимптомных контактных лиц и членов семьи пациента с БГСА-инфекцией не рекомендуется.
Таблица 1. Дозы и режим применения антибиотиков при остром БГСА-тонзиллите
Примечания:
1 — допускается применение амоксициллина в дозе 20 мг/кг 2 раза в день или 50 мг/кг 1 раз в день в течение 10 дней. Это увеличивает вероятность соблюдения пациентом врачебных назначений без ухудшения клинического и бактериологического результата терапии;
2 — с учетом узкого спектра действия феноксиметилпенициллин является оптимальным для лечения БГСА-тонзиллита, однако в настоящее время этот препарат в республике не зарегистрирован;
3 — пролонгированные пенициллины в качестве средства для лечения ангины показаны в случаях низкой комплаентности пациентов, при наличии ревматической лихорадки в анамнезе у больного или его ближайших родственников, неблагоприятных социально-бытовых условиях, вспышках БГСА-инфекции в детских дошкольных учреждениях, школах, интернатах, училищах;
4 — для эритромицина характерно наиболее частое, по сравнению в другими макролидами, развитие побочных реакций, особенно со стороны ЖКТ;
5 — схемы одобрены FDA;
6 — cогласно последним данным, ранее одобренная Фармкомитетом РФ схема (10 мг/кг/сут в 1 прием в течение 3 дней, курсовая доза 30 мг/кг) значительно уступает по бактериологической эффективности как 5-дневной схеме (12 мг/кг/сут в 1 прием в течение 5 дней, курсовая доза 60 мг/кг), так и препаратам сравнения.
Таблица 2. Дозы и режим применения антибиотиков при хроническом рецидивирующем БГСА-тонзиллите
Необходима ли сопроводительная терапия?
Другие назначения не являются обязательными. До сих пор больным рекомендуется сопроводительная терапия нестероидными противовоспалительными средствами (НПВС) и антигистаминными препаратами. Однако НПВС подавляют инфекционное воспаление, цель которого — ограничить и уничтожить инфекцию, а на развитие иммунопатологических реакций не влияют. НПВС при ангине следует назначать при сильной боли в горле (в течение первых 1–3 дней) и как жаропонижающее при высокой температуре (выше 39 °С).
Показания для назначения антигистаминных препаратов при БГСА-инфекции отсутствуют, поскольку гистамин при инфекционном процессе и иммунопатологических реакциях не играет существенной роли в развитии патологического процесса (просто является одним из многих медиаторов воспаления), а иммунные осложнения БГСА-инфекции не относятся к IgE-опосредованным. Назначение этих препаратов для профилактики медикаментозной аллергии также не показано, во-первых, потому, что препарат, вызывающий аллергию, должен быть всегда отменен, во-вторых, любые лекарственные комбинации повышают риск аллергических и токсических реакций.
Местная терапия ОТФ очень популярна в нашей стране, за рубежом не проводится, поскольку эффективность ее не доказана. Более того, обработка ватными тампонами воспаленных (с гнойным налетом) миндалин, особенно в домашних условиях, приводит к их травматизации, более глубокому проникновению инфекции, повышает риск осложнений и хронического течения. Целесообразность использования всевозможных спреев также вызывает сомнения, поскольку их экспозиция не превышает нескольких секунд: они смываются слюной и не обнаруживаются уже после первого глотка.
Популярны при ангине пастилки и таблетки для рассасывания. Они действительно облегчают боль в горле за счет анестезирующего компонента (чаще всего ментола), однако входящие в их состав антисептики, в отличие от антибиотиков, имеющих определенный спектр действия, уничтожают любую микрофлору ротоглотки и способствуют развитию дисбиоза. Аналогичным обезболивающим эффектом обладает теплое питье (чай или молоко с медом и малиной и др.).
Полоскания глотки также не рекомендуются в большинстве стран мира: при запрокидывании головы происходит раскрытие лакун, что облегчает проникновение инфекции в их глубину.
Медицинский вестник, 1,8 августа 2017