абляция печени что это такое
Абляция печени что это такое
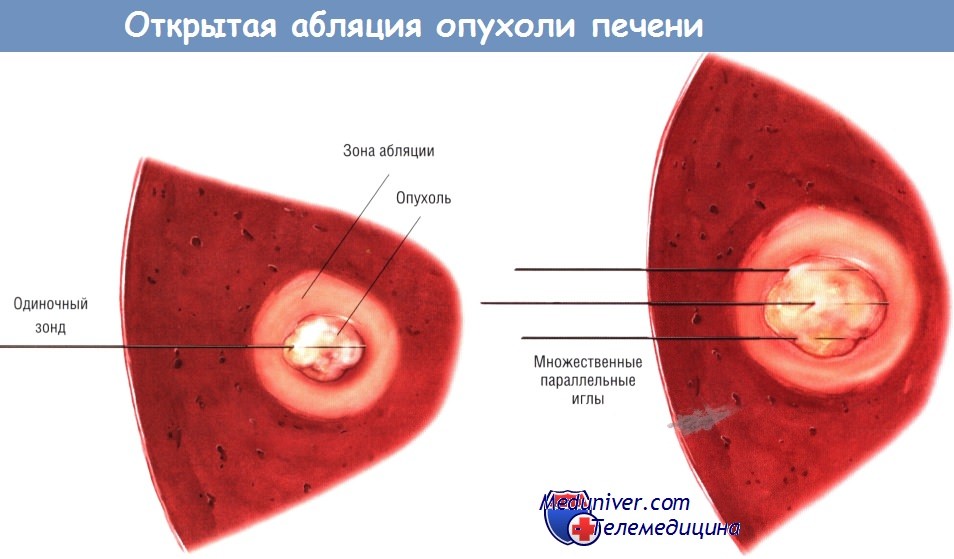
а) Радиочастотная абляция через открытый доступ. РЧА можно выполнить во время лапаротомии. Так поступают в случаях, когда нужно дополнить РЧА резекцию печени, если необходимо обработать много опухолей, а также если локализация опухоли не позволяет применить другой доступ.
Проводя РЧА при открытой лапаротомии, в первую очередь тщательно исследуют брюшную полость, чтобы исключить опухоли внепечёночной локализации. В том числе осматривают листки брюшины и области перипортальных лимфатических узлов. Затем выполняют тщательную пальпацию и интраоперационное УЗИ печени. Если биопсию не проводили ранее, следует иметь в виду необходимость биопсии центральной части опухоли под контролем интраоперационного УЗИ.
Большое значение имеет тщательное планирование зоны абляции, обеспечивающее полный некроз цели. В некоторых случаях, при использовании удлиняющейся многоэлектродной иглы достаточного размера, абляцию можно провести за одно введение иглы в центр опухоли. Например, сферическая опухоль диаметром 3 см и окружающая её зона шириной 1 см могут быть обработаны устройством, создающим некротический участок диаметром 5 см.
После того как опухоль обнаружена датчиком интраоперационного УЗИ, в неё под ультразвуковым контролем вводят игольчатый электрод для РЧА. Лучше всего проводить электрод в плоскости излучателя: в этом случае путь иглы можно увидеть полностью. При использовании многоэлектродной иглы её контакты развёртываются внутри опухоли, причём их расположение подтверждают с помощью УЗИ, сделанного в двух проекциях.
Другие конструкции зондов имеют одну или множество параллельных игл. Некоторыми устройствами для РЧА абляцию центральной части опухоли проводят частично разведёнными электродами, в последующем последние раздвигают на желаемый объём.
Наблюдение за термической абляцией можно проводить различными способами. Некоторые устройства для РЧА позволяют измерить температуру ткани вмонтированными в них термисторами. Другой способ контроля—мониторирование импеданса ткани и величины тока. В некоторых устройствах ток на выходе регулируется автоматически для контроля импеданса и поддержания температуры тканей в пределах 70-105 °С. Зона абляции во время лечения визуализируется интраоперационным УЗИ.
Обычно образование микроскопических газовых пузырей приводит к гиперэхогенности обрабатываемой ткани.
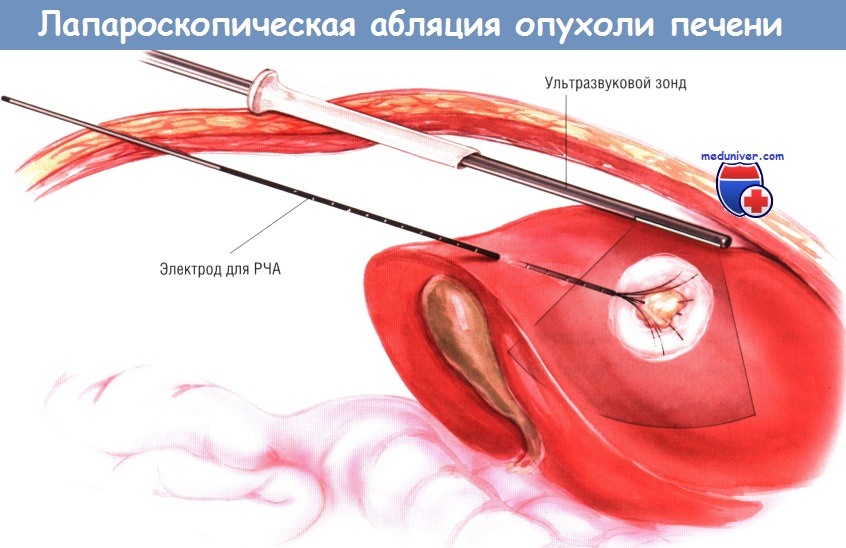
б) Лапароскопическая радиочастотная абляция. Лапароскопическая РЧА выгодна своей малой инвазивностью, возможностью осмотра брюшной полости и проведения лечения под контролем УЗИ. Процедуру проводят под общим обезболиванием. Больной обычно лежит на спине. В большинстве случаев операцию можно сделать через два или три порта. Лапароскоп проводят через порт около пупка, а датчик интраоперационного УЗИ устанавливают через 12-миллиметровый порт, расположенный справа.
При необходимости можно добавить «рабочий» порт с 5-миллиметровой гильзой троакара. Обычно печень частично мобилизуют и отодвигают ткани на 2 см от периферии предполагаемой зоны абляции. Если разрушаемая опухоль лежит около желчного пузыря, можно выполнить холецистэктомию. Электрод для РЧА вводят в брюшную полость чуть ниже и параллельно датчику для интраоперационного УЗИ либо чрескожно, либо через 5-миллиметровый троакар.
Иглу устанавливают в опухоль под контролем интраоперационного УЗИ, причём абляцию проводят и мониторируют так же, как и при открытой операции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Хирургия»
Радиочастотная абляция печени
Современные технологии медицины, связанные с лечением рака, ставят перед собой уже новые задачи – не просто лечение, но и уменьшения вредного влияния на здоровые органы и ткани за счет максимально точного воздействия на новообразование (абляция и фотодинамическая терапия). Достигнуть этого можно путем точечной доставки лекарственных средств к пораженным тканям (радио- и химиопрепараты) с дальнейшей эмболизацией сосудов.
Абляция – это способ воздействия на опухоль температурных или химических факторов (возможно их комбинирование), в результате которого происходит деструкция и гибель раковых клеток. Для максимально точного воздействия в новообразование вводится электрод, с помощью которого происходит подача тока с частотой около 400-500 Гц.
Первые клинические испытания абляции рака печени и обоснования радиочастотной термодеструкции прошли в 80-90 годах. По итогам наблюдений отмечались положительные результаты даже в случаях, которые ранее считались безнадежными. Далее была применена радиочастотная абляция (РЧА) рака легких, почек и поджелудочной железы. На начальных этапах применения методики воздействие распространялось на небольшой объем пораженной ткани, до 2 см. Сейчас аппаратура усовершенствована и позволяет за одну процедуру получить деструкцию в пределах 7 см.
Рак печени и РЧА
За 30 лет применения данной методики были сделаны выводы о ее эффективности и разработан список показаний к РЧА:
• Ранее перенесенная радикальная операция на печени при отсутствии метастазов за пределами органа;
• Выявление в печени не более 5 метастазов с посторонним источником. При наличии нейроэндокринного новообразования допустимое количество метастазов печени может возрастать;
• Размер очага до 4 см (большие размеры допускаются при наличии положительных результатов от других способов лечения, например химиотерапии);
• Не полностью излеченная опухоль ранее проводимым лечением;
• Рецидив после эффективно проведенного лечения, в том числе и РЧА;
• Возникновение «подсыпающих» (различных по времени) метастазов после резекции печени или любого другого лечения;
• Новообразования, выявленные с помощью УЗИ или КТ исследований;
• Расстояние между опухолью и магистральными сосудами и желчными протоками более 1 см.
Противопоказания к РЧА
К противопоказаниям в некоторых случаях могут относиться:
• распад опухолевой ткани;
• близкое расположение к желчному пузырю и крупным желчным протокам (может послужить причиной болевого синдрома во время проведения процедуры);
• близкое расположение к диафрагме (также может вызывать возникновение боли различной интенсивности и продолжительности);
• расстояние менее 1 см до крупных сосудов (воротная вена, печеночная артерия), нервных пучков;
• количество метастазов более 5 (за исключением случаев высокодифференцированных опухолей или имеющих продолжительный период роста).
Довольно часто схема лечения, включающая абляцию наиболее крупных узлов с последующей химио- или иммунотерапией, дает хороший результат в случае гормонально активных опухолей нейроэндокринного происхождения.
Результаты РЧА
Основным критерием эффективности локальной деструкции и отдаленной выживаемости является частота полных некрозов. Данный показатель в большой степени зависит от особенностей опухоли и ее размеров и может варьировать от 24 до 98%. Наилучшие результаты были получены при размере опухоли до 2 см. Пропорционально увеличению размера опухоли растет и риск возникновения рецидивов, но это не значит, что необходимо отступать от техники проведения абляции и будет получен отрицательный результат.
Предварительные расчеты объема ткани, подлежащей некрозу, не должны превышать допустимые для сохранения жизнедеятельности и функциональности органа. Для коррекции сроков и объема повторного лечения важную роль играет оценка изменений органа во время проведения первой процедуры, особенностей кровоснабжения органа и вероятности возникновения рецидивов.
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Радиочастотная абляция опухолей печени
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения и социального развития Республики Казахстан
от «29» ноября 2016 года
Протокол №16
Приложение 1
к типовой структуре
Клинического протокола диагностики и лечения
Название оперативного и диагностического вмешательства: Радиочастотная абляция опухолей печени.
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Цель проведения процедуры/вмешательства: целью радиочастотной абляции (РЧА) является полный некроз злокачественного новообразования в печени (первичного и метастатического) с возможностью длительной безрецидивной выживаемостью.
Радиочастотная абляция – это метод разрушения опухолевой ткани с помощью высокоэнергетических радиоволн, в процессе которого происходит нагревание клеток опухоли до высоких температур и, как следствие, их гибель. Радиочастотная абляция способствует как частичному, так и полному удалению опухоли.
Показания и противопоказания для проведения процедуры/ вмешательства:
Показания к проведению РЧА злокачественных (первичных и метастатических) опухолей печени:
· наличие противопоказаний к хирургической резекции печени, отказ в хирургическом лечении;
· отсутствие внепеченочных проявлений заболевания;
· наличие в печени 1 опухолевого узла до 5 см либо 3–4 узлов до 3 см в диаметре;
· остаточная опухоль после ранее проведенной РЧА либо другого метода лечения;
· местный рецидив после ранее проведенной РЧА, резекции печени либо другого метода лечения;
· опухоли, визуализируемые при УЗКТ, РКТ;
· возможность безопасного доступа к опухоли (расположение узлов не ближе 1 см от воротной либо печеночных вен, долевых желчных протоков);
· согласие больного на проведение лечения.
Противопоказания к проведению РЧА злокачественных опухолей печени
Абсолютные:
· некорригируемая коагулопатия;
· сепсис;
· энцефалопатия;
· декомпенсированный цирроз (Child-Pugh C);
· терминальная стадия болезни (Okuda III);
· активное желудочно-кишечное кровотечение;
· некупируемый асцит.
Относительные:
· наличие у пациента искусственного водителя ритма;
· внепеченочные проявления заболевания;
· почечная недостаточность;
· несмещаемое прилежание опухолевого узла к соседним органам (желчный пузырь, желудок, кишечник) и крупным желчным протокам.
Перечень основных и дополнительных диагностических мероприятий (отдельно перечислить основные/обязательные и дополнительные обследования, консультации специалистов с указанием цели и показаний):
Основные (обязательные) диагностические обследования:
· ОАК с тромбоцитами;
· ОАМ;
· Группа крови и резус-фактор;
· Биохимический анализ крови: общий белок с фракциями, АЛТ, АСТ, общий/прямой билирубин, ЩФ, ГГТП, ЛДГ, креатинин, мочевина, амилаза, глюкоза;
· Электролиты: калий, натрий;
· Микрореакция;
· Коагулограмма: протромбиновое время, МНО, АЧТВ, фибриноген;
· Маркеры вирусных гепатитов: HBsAg, anti-HCV, ВИЧ;
· Альфа-фетопротеин;
· УЗИ органов брюшной полости;
· Рентгенография органов грудной клетки
Методика проведения процедуры/вмешательства
Требования к оснащению, расходным материалам, лекарственным средствам: согласно приказа и.о. Министра здравоохранения Республики Казахстан от 12 августа 2011 года № 540 «Об утверждении Положения о деятельности организаций здравоохранения, оказывающих онкологическую помощь населению Республики Казахстан».
Требования к оснащению, расходным материалам, медикаментам:
· Наличие всех инструментов/оборудования, необходимых для радиочастотной абляции рака печени-генератора, системы охлаждения;
· Помещение должно быть оснащено системой вентиляции, обеспечивающей оптимальные условия для профилактики хирургической инфекции и работы с газами, используемыми при анестезии;
· Наличие инструментов, расходных материалов и оборудования для проведения анестезиологического пособия. Инструменты и оборудование должны находиться непосредственно в операционной или смежных помещениях и быть доступны в любое время;
· Любая сертифицированная система для РЧА опухолей: одноигольчатые электроды с максимальным диаметром воздействия 3 см, выдвигающиеся электроды с максимальным диаметром воздействия 5см и др;
· Система лучевой навигации: РКТ,УЗИ, МРТ;
· Анестезиологическое оборудование (аппарат для искусственной вентиляции легких, монитор для контроля сердечной деятельности, артериального давления, сатурации и др.);
· Динамический контроль: КТ с внутривенным контрастным усилением, ПЭТ/КТ, МРТ с внутривенным контрастным усилением. Критерии оценки результатов: mRECIST, EASL.
Основные расходные материалы:
· Набор белья для чреспеченочных процедур;
· Комплект кластерных или 1-3 одиночных электродов для РЧА;
· Генератор;
· Насос и Система охлаждения;
· Емкость для воды;
· Ножной выключатель;
· Ультразвуковой аппарат
Дополнительные расходные материалы:
· Венозный катетер;
· Система одноразовая для инфузий;
· Скальпель одноразовый;
· Марля медицинская;
· Шприцы 20 мл;
· Шприцы 10 мл;
· Перчатки стерильные;
· Перчатки нестерильные;
· Шапочки одноразовые;
· Маски хирургические;
· Бахилы одноразовые;
· Одноразовые электроды для ЭКГ
Требования к подготовке пациента:
· вечером накануне операции легкий ужин до 20.00;
· в день операции – голод;
· побрить операционное поле накануне операции;
· провести перед операцией все гигиенические процедуры: прополоскать полость рта, почистить зубы, снять съемные зубные протезы, очистить полость носа, мужчинам побриться;
· обработка операционного поля препаратами бактерицидного действия;
Методика проведения процедуры/вмешательства:
· Собрать систему для радиочастотной абляции по инструкции;
· Положение больного – лежа на спине, либо на боку в зависимости от доступа;
· Возвратные электроды пациента зафиксировать на бедрах пациента;
· Процедура проводится, как правило, под внутривенной наркозом или интубационным анестезией;
· Выбор электрода определялся размером очага и удаленностью от поверхности кожи;
· Пункция очага производится под УЗ-контролем (консвексный датчик 3.5 МГц с пункционным адаптером), необходимо, чтобы аблационная часть иглы располагалась в центре опухоли. При выявлении эксцентрического расположения электрода необходимо произвести повторную пункцию очага с предварительной термообработкой старого пункционного канала во избежание кровотечения или опухолевой диссеминации, либо введение дополнительных электродов в очаг и обработка его из нескольких точек;
· Можно ввести несколько электродов одномоментно при наличии несколько рядом расположенных очагов во избежание «потери» очага после РЧА соседнего;
· Удостоверившись в правильном расположении электрода, начинается воздействие на опухоль током частотой 450-500 кГц. В результате опухолевая ткань разогревается до температуры (60-90°С), при которой происходят необратимые изменения в клетках. Опухолевая масса некротизируется. Время воздействия на опухоль 12 минут, если опухоль до 3см. Для очень крупных опухолей игольчатые электроды группируют по три в одной рукоятке (электрод-кластер) на расстоянии 0,5 см параллельно друг другу. Именно такие охлаждаемые инструменты позволяют быстро коагулировать опухоли 5-7 см в диаметре и больше. В конце 12-минутного сеанса лечения электрод извлекается при работающем генераторе и коагулирует пункционный канал.
Индикаторы эффективности процедуры/вмешательства:
· отсутствие в послеоперационный период выявляемого всеми доступными визуализационными методами роста резидуальных опухолевых очагов в зоне выполненной абляции;
· отсутствие послеоперационных осложнений (осложнений, связанных с доступом и процедурой);
· снижение количества инвалидизирующих оперативных вмешательств;
· возможность многократного миниинвазивного проведения РЧА деструкции;
· повышение ожидаемой продолжительности жизни;
· повышение качества жизни.
Информация
Источники и литература
Информация
Список разработчиков протокола с указанием квалификационных данных:
1) Боровский Сергей Петрович – доктор медицинских наук, АО «Национальный научный центр онкологии и трансплантологии», заведующий отделением интервенционной рентгенохирургии.
2) Калиаскарова Кульпаш Сагындыковна – доктор медицинских наук, главный внештатный гепатолог МЗСР РК, руководитель координационного центра гепатологии и гастроэнтерологии КФ «UMC».
3) Малаев Нияз Бейсенович – MSc, MBA., АО «Национальный научный центр онкологии и трансплантологии», врач рентгенохирург высшей категории, отделения «Интервенционной рентгенохирургии».
4) Нурсеитов Ильяс Ержанович – врач интервенционный рентгенохирург, «Казахский национальный научный исследовательский институт онкологии и радиологии».
Указание на отсутствие конфликта интересов: нет.
Рецензент:
1) Кузикеев Марат Оразович – доктор медицинских наук, профессор, руководитель центра абдоминальной онкологии «Казахская научно-исследовательский институт онкологии и радиологии».
Указание условий пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Рак печени является крайне опасным и быстро прогрессирующим онкологическим заболеванием. По морфологической структуре опухоли печени подразделяются на 2 основные группы – первичные, то есть изначально возникшие непосредственно в самой печени, и вторичные (метастатические), которые образовались в печени из раковых клеток опухолей других органов и систем через кровоток. Первичный рак печени является довольно редким онкологическим заболеванием, на который приходится менее 1,5% (8 810) от общего числа пациентов обоего пола с первые в жизни установленным диагнозом злокачественного новообразования в России в 2018 году1. Вторичный рак печени напротив диагностируется достаточно часто и до такой степени, что практически у каждого третьего онкологического пациента вне зависимости от расположения первичной опухоли выявляются метастазы в печени, что объясняется функциональными и анатомическими особенностями органа.
Однако по разным объективным причинам хирургическое лечение доступно не более чем для 20% всех пациентов. Это связано как с тяжелой формой заболевания или неоперабельной локализацией опухоли, так и с общим состоянием здоровья пациента, не позволяющим выполнить открытую или лапароскопическую радикальную хирургическую операцию.
В настоящее время в борьбе с онкологическими заболеваниями печени активно используются минимально инвазивные технологии и методы локального лечения, позволяющие существенно продлить жизнь неоперабельным пациентам. К таким методам лечения относятся химиоэмболизация, радиоэмболизация и различные технологии локальной термической абляции. Все эти минимально инвазивные методы могут быть использованы как в качестве самостоятельного метода лечения, так и в комбинации друг с другом, в том числе с хирургией. Мировой и отечественный опыт применения методов локального лечения показывает, что в ряде случаев их эффективность не уступает результатам традиционной хирургии2 при воздействии на ранние формы первичного или метастатического рака печени.
Локальная термическая абляция опухолей не является экспериментальным методом лечения и уже не один десяток лет успешно практикуется при лечении различных онкологических заболеваний. К наиболее часто используемым технологиям локальной термической абляции опухолей печени относятся радиочастотная (РЧА) абляция, микроволновая абляция и криоабляция. Благодаря надежным отдаленным результатам лечения, подтвержденным клиническими испытаниями и исследованиям, и высокой безопасности, в 2016 году все три технологии были включены в клинические рекомендации Европейского сообщества медицинской онкологии ESMO5 по лечению метастатического колоректального рака. В 2018 году радиочастотная и микроволновая абляция были также включены в клинические рекомендации EMSO6 по лечению первичного гепатоцеллюлярного рака.
Микроволновая абляция
Микроволновая (или СВЧ) абляция относится к гипертермическим технологиям внутритканевой термоабляции опухолей, поскольку деструкция и некроз опухолевой ткани возникают под воздействием экстремально высоких температур локально создаваемых в тканях под воздействием микроволнового излучения. При микроволновой абляции в опухолевую ткань вводится специальный инструмент – антенна с излучающей секцией на кончике, которая подключена к микроволновому генератору. Если опухоль крупная или их несколько, то одновременно могут использоваться несколько таких инструментов.
Антенна для микроволновой абляции и введение антенны в опухоль под контролем ультразвука
В большинстве случаев введение антенны в опухоль осуществляется перкутанно, то есть через кожный прокол не требующий хирургических разрезов. Процесс введения инструмента в опухоль с высокой точностью контролируется различными методами лучевой визуализации тканей, например, ультразвуком или компьютерным томографом. В ряде случаев, микроволновая абляция опухоли может также выполняться открытым или лапароскопическим доступом. Выбор доступа определяется от тактики лечения, количества и размеров опухолевых узлов, общего состояния здоровья больного и других факторов. Например, открытым или лапароскопическим доступом микроволновая абляция в большинстве случаев назначается при комбинированном лечении с хирургической резекцией или если по тем или иным причинам проведение операции чрескожным доступом не предоставляется возможным.
После установки антенны в опухоли и подтверждения точности её расположения, антенны подключаются к генератору, который по специальному кабелю (волноводу) передает электромагнитную энергию высокой частоты в диапазоне от 2 400 – 2 500 МГц в опухолевую ткань. Под воздействием электромагнитного излучения молекулы воды, находящиеся в тканях, начинают вращаться с огромной скоростью до 5 миллиардов раз в секунду. В следствие этого под воздействием силы трения кинетическая энергия преобразуется в тепловую, происходит мгновенный нагрев тканей до экстремально высоких температур, превышающих >150 ◦C, приводящих к коагуляционному некрозу и гибели раковых клеток. Таким образом формируется зона абляции, которая постепенно охватывает всю опухолевую ткань.
Генератор для микроволновой абляции. Микроволновая абляция опухоли
При микроволновой абляции высокочастотная энергия фокусируется исключительно в опухоли, здоровые ткани при этом не повреждаются. Дополнительную безопасность от термических ожогов или повреждений смежных органов и тканей обеспечивает непрерывная циркуляция охлаждающей жидкости, температура которой контролируется встроенным в антенну температурным датчиком. Поэтому если температура достигнет критических значений, то подача микроволнового излучения автоматически прервется.
После завершения процесса абляции на коже остается небольшой прокол, не требующий наложения швов. Поскольку процедуры микроволновой абляции являются малоинвазивными, а, следовательно, легко переносятся организмом, то в большинстве случаев из клиники выписывают уже на следующей день после вмешательства. В дальнейшем опухоль наблюдается. При необходимости микроволновую абляцию можно выполнить повторно.
Показания к применению микроволновой абляции
Опухоль печени до абляции. Опухоль печени после абляции – полный некроз и отсутствие признаков роста
Микроволновая абляция опухолей печени, почек и легких
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «11» января 2019 года
Протокол №51
Микроволновая абляция – разрушения опухолевой ткани с помощью высокоэнергетических микроволн, в процессе которого происходит нагревание клеток опухоли до высоких температур и, как следствие, их гибель.
Код(ы) МКБ-10
| МКБ-10 | |
| Код | Название |
| С34 | Злокачественные новообразования бронхов и легких |
| С22 | Злокачественные новообразования печени и внутрипеченочных желчных протоков |
| С64 | Злокачественные новообразования почек |
Дата пересмотра/разработки протокола: 2018 год.
Сокращения, используемые в протоколе:
| ЗНО | – | злокачественное новообразование |
| КТ | – | компьютерная томография |
| МВА | – | микроволновая абляция |
| РЧА | – | радиочастотная абляция |
| УЗИ | – | ультразвуковое исследование |
Пользователи протокола: врачи онкохирурги, торакальные хирурги, интервенционные радиологи, онкоурологи, онкогинекологи, онкологи и др.
Категория пациентов: взрослые, дети старшей возрастной группы.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Перечень основных и дополнительных диагностических мероприятий
Основные (обязательные) диагностические обследования:
Дополнительные диагностические обследования:
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ЛЕЧЕНИЯ
Цель проведения процедуры/вмешательства: полный некроз злокачественного новообразования с возможностью длительной без рецидивной выживаемостью.
Показания и противопоказания для проведения процедуры/вмешательства
Показания к проведению МВА злокачественных (первичных и метастатических) опухолей печени:
— наличие противопоказаний к хирургической резекции печени, отказ в хирургическом лечении;
— отсутствие внепеченочных проявлений заболевания;
— наличие в печени 1 опухолевого узла до 5 см либо 3–4 узлов до 3-4 см в диаметре;
— остаточная опухоль после ранее проведенной РЧА либо другого метода лечения;
— местный рецидив после ранее проведенной РЧА, резекции печени либо другого метода лечения;
— опухоли, визуализируемые при УЗКТ, РКТ;
— возможность безопасного доступа к опухоли (расположение узлов не ближе 1 см от воротной либо печеночных вен, долевых желчных протоков);
— согласие больного на проведение лечения.
Показания к проведению МВА злокачественных (первичных и метастатических) опухолей почек:
— наличие противопоказаний к хирургической резекции, отказ в хирургическом лечении;
— наличие у больного единственной почки и высокий риск полной потери функции почки вследствие хирургического удаления почки;
— генетическая предрасположеность больных к развитию множественных опухолей (BHD, VHL);
— опухоль, визуализируемая при КТ, УЗИ;
— согласие больного на проведение МВА;
— отсутствие внепочечных проявлений заболевания;
— размеры опухолевого узла меньше 5 см в диаметре.
Показания к проведению МВА злокачественных опухолей легких:
— больные НМРЛ I–II стадий, не подлежащие хирургическому лечению по следующим причинам: сопутствующие заболевания;
— отказ пациента от хирургического лечения;
— отсутствие внелегочных проявлений заболевания;
— рецидив опухоли менее чем через 6 мес. после резекции легкого;
— удаленная первичная опухоль (при метастазах в легких);
— больные, имеющие несколько метастазов (всего не более 6) в разных долях легких;
— менее 3 метастазов в каждом легком;
— диаметр опухоли до 4 см;
— опухоли, визуализируемые при КТ;
— локализация опухоли не ближе 1 см от прикорневых структур;
— согласие больного на проведение лечения.
Противопоказания к проведению МВА злокачественных новообразований
Противопоказания к МВА опухолей печени:
Абсолютные:
— не корригируемая коагулопатия;
— сепсис;
— энцефалопатия;
— декомпенсированный цирроз (Child-Pugh C);
— терминальная стадия болезни (Okuda III);
— активное желудочно-кишечное кровотечение;
— не купируемый асцит.
Относительные:
— внепеченочные проявления заболевания;
— печеночная/почечная недостаточность;
— не смещаемое прилежание опухолевого узла к соседним органам (желчный пузырь, желудок, кишечник) и крупным желчным протокам.
Противопоказания к МВА опухолей почек:
Абсолютные:
— некоррегируемая коагулопатия;
— сепсис;
— первичная опухоль не удалена;
— сосудистая инвазия.
Относительные:
— ожидаемая продолжительность жизни больше года;
— центральная локализация опухоли.
Противопоказания к МВА злокачественных опухолей легких:
Абсолютные:
— некоррегируемая коагулопатия;
— сепсис;
— метастатический плеврит.
Относительные:
— опухолевые узлы прилежат к диафрагме либо располагаются ближе 1 см к прикорневым структурам;
— расположение опухоли рядом с крупными сосудами (аорта, легочные артерии), пищеводом, грудной стенкой, диафрагмой;
— близость сосудов> 3 мм в диаметре;
— первичная опухоль не удалена;
— более 3 метастазов в каждом легком;
— общее количество метастазов более 6.
Методика проведения процедуры/вмешательства
Информация
Источники и литература
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Малаев Нияз Бейсенович – MD, MMSc, MBA., онколог высшей квалификационной категории, врач интервенционный радиолог АО «Национальный научный медицинский центр»;
2) Колос Анатолий Иванович – доктор медицинских наук, торакальный хирург высшей квалификационной категории АО «Национальный научный медицинский центр»;
3) Искаков Ербол Амангельдинович – PhD, врач уролог высшей квалификационной категории руководитель отдела урологии АО «Национальный научный медицинский центр»;
4) Нурсеитов Ильяс Ержанович – врач интервенционный радиолог АО «Казахский научно-исследовательский институт онкологии и радиологии».
Указание на отсутствие конфликта интересов: нет.
Рецензент:
1) Кузикеев Марат Оразович – доктор медицинских наук, профессор, руководитель центра абдоминальной онкологии АО «Казахский научно-исследовательский институт онкологии и радиологии».
2) Карасаев Максат Исмагулович – кандидат медицинских наук, руководитель центра торакальной онкологии АО «Казахский научно-исследовательский институт онкологии и радиологии».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.