c max в фармакологии что такое
C max в фармакологии что такое
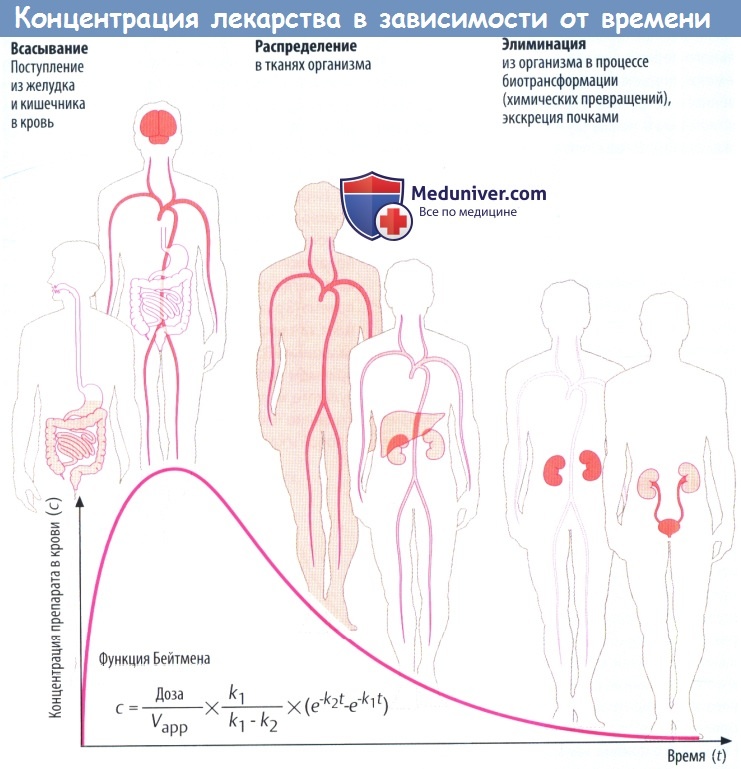
(А) Лекарственные средства попадают в организм и выводятся из него разными путями. Таким образом, организм представляет собой открытую систему, в которой фактическая концентрация препарата отражает взаимодействие между его поступлением (приемом) и эвакуацией (элиминацией).
Скорость всасывания препарата в желудке и кишечнике зависит от множества факторов: скорости растворения вещества (в случае приема твердой лекарственной формы) и транзита по ЖКТ, проницаемости слизистой для препарата, его градиента концентрации на границе слизистой и крови,кровоснабжения слизистой оболочки.
Всасывание из кишечника приводит к повышению концентрации лекарственного вещества в крови. Препарат разносится с кровью к различным органам (распределение), которые поглощают его в количестве, соответствующем его химическим свойствам и скорости кровотока через орган.
Например, органы с хорошим кровоснабжением, такие как головной мозг, получают большее количество препарата, чем органы с низким кровоснабжением. В результате поглощения тканями происходит снижение концентрации лекарственного вещества в крови. По мере снижения градиента на границе слизистой оболочки и крови всасывание в кишечнике замедляется. Пик концентрации в крови достигается тогда, когда количество вещества, покидающего кровь за единицу времени, равно количеству всосавшегося.
Поступление вещества в ткани печени и почек представляет собой перемещение в органы выведения. Концентрация препарата в крови в различные периоды времени представляет собой совокупность процессов абсорбции, распределения и элиминации, которые пересекаются во времени.
Если распределение происходит значительно быстрее, чем элиминация, снижение концентрации в крови вначале происходит быстро, а затем замедляется. Фаза быстрого снижения обозначается как α-фаза (фаза распределения), медленного — как β-фаза (фаза элиминации). Если препарат распределяется быстрее, чем абсорбируется, концентрацию препарата в крови можно описать математически упрощенной функцией Бейтмена (k1 и k2 — константы скорости для абсорбции и элиминации соответственно).
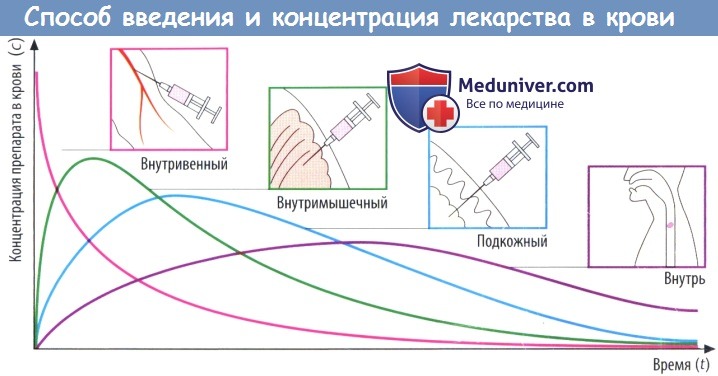
(В) Скорость абсорбции зависит от способа введения препарата. Чем выше скорость абсорбции, тем короче будет время (tmax), которое требуется для достижения пика концентрации в плазме (cmax), тем выше будет cmax и тем раньше уровень препарата в крови снова начнет снижаться.
Площадь под кривой, описывающей зависимость концентрации препарата в крови от времени (AUC), не зависит от пути введения препарата при условии, что доза и биодоступность остаются теми же (закон соответственных состояний). Таким образом, AUC можно использовать для вычисления биодоступности (F) препарата.
Значение AUC, измеренное после приема внутрь и в/в введения определенной дозы конкретного лекарственного вещества, соответствует проценту вещества, попавшего в системный кровоток после приема внутрь: F = AUCприем внутрь/AUCв/в введение.
Определение концентрации препарата в крови позволяет сравнить различные патентованные лекарственные средства, содержащие одно и то же действующее вещество в одинаковой дозе. Идентичные кривые зависимости концентрации в крови от времени для препаратов различных производителей (при условии стандартных лекарственных форм) означают биоэквивалентность стандартного вещества и нового исследуемого препарата.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
C max в фармакологии что такое
Смотреть что такое «Cmax» в других словарях:
Cmax — Cette page d’homonymie répertorie les différents sujets et articles partageant un même nom. Cmax peut désigner : la Ford C MAX, une voiture construite par Ford Cmax, un dessinateur et scénariste de bande dessinée français. Ce document… … Wikipédia en Français
Cmax — may refer to: Customatix, a footwear company C Max, a maximum security prison in South Africa Ford C MAX, a model of car Cmax (pharmacology) the maximum concentration of a drug in the body after dosing. CMAX, a crisis indicator designed by Patel… … Wikipedia
CMAX — Cette page d’homonymie répertorie les différents sujets et articles partageant un même nom. Cmax peut désigner : la Ford C MAX, une voiture construite par Ford Cmax ou Maximilien Leroy, un dessinateur et scénariste de bande dessinée français … Wikipédia en Français
Cmax — maximum concentration; peak lidocaine concentration … Medical dictionary
Cmax — maximum concentration; peak lidocaine concentration … Medical dictionary
CMAX — Caius Maximius … Abbreviations in Latin Inscriptions
Cmax — • maximum concentration; • peak lidocaine concentration … Dictionary of medical acronyms & abbreviations
Cmax (pharmacology) — Cmax is a term used in pharmacokinetics refers to the maximum (or peak) concentration that a drug achieves in tested area after the drug has been administrated and prior to the administration of a second dose. Cmax is the opposite of Cmin, which… … Wikipedia
Кадуэт — Действующее вещество ›› Амлодипин* + Аторвастатин* (Amlodipine* + Atorvastatin*) Латинское название Caduet АТХ: ›› C10BX03 Амлодипин + Аторвастатин Фармакологическая группа: Блокаторы кальциевых каналов в комбинациях Нозологическая классификация… … Словарь медицинских препаратов
Зетамакс ретард — Действующее вещество ›› Азитромицин* (Azithromycin*) Латинское название Zetamax retard АТХ: ›› J01FA10 Азитромицин Фармакологическая группа: Макролиды и азалиды Нозологическая классификация (МКБ 10) ›› J01 Острый синусит ›› J13 Пневмония,… … Словарь медицинских препаратов
16,Биологическая доступность, Биоэквивалентность. Пик концентрации лекарственных средств в крови. Время достижения максимальной концентрации.
17.Биодоступность, фармакологическая, терапевтическая эквивалентность, биоэквивалентность.
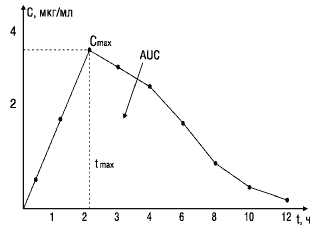
Cmax — максимум, или пик концентрации ЛВ в крови;tmax — время достижения максимал. концентрации вещества в плазме крови;AUC — площадь под фармакокинетической кривой — кривой «концентрация—время» (изменение концентрации активного вещества в плазме или сыворотке крови во времени).Ппримера: Кривая 1 характеризует концентрацию в крови стандартного препарата, кривая 2 — тестируемого. Горизонтальной линией отмечена минимальная эффективная концентрация, при которой данное вещество оказывает терапевтическое действие. Как видно, Сmax тестируемого препарата (кривая 2) не достигает уровня минимальной эффективной концентрации и, следовательно, не оказывает терапевтического действия.
МЭК — минимальная эффективная концентрация; 1 — стандартный препарат;2—тестируемый препарат; Сmax1, Сmax2 — соответствующие максимальные концентрации сравниваемых препаратов в крови
18 Медицина, основанная на доказательствах. Уровни доказательности. Формулярная система: цель и ее компоненты.
Доказательная медицина – медицинская практика, при которой выбор медицинских вмешательств (терапевтических и диагностических) базируется на фактах, полученных при проведении качественных клинических исследований
Уровень доказательности:Категория доказательства А – доказательства основаны на законченных и хорошо спланированных рандомизированных контролируемых исследованиях (РКИ); использован совершенный математический аппарат. Категория доказательства В – доказательства получены на основе РКИ. Доказательства ограничены, так как в конечной части могут быть распространены на ограниченную популяцию.Категория доказательства С – доказательства не основаны на РКИ. Источник доказательства – нерандомизированные исследования.Формулярная система Цель: достижение максимального терапевтического эффекта наиболее безопасным и экономичным путем —рациональный отбор ЛС —экономически выгодные закупки препаратов —клиническая оценка эффективности
Формулярная система Компоненты формулярной системы:.протоколы лечения заболеваний.списки лекарственных средств (формулярные списки) на основе достоверной информации.справочные пособия по Формулярной системе.лечебно-профилактические учреждения города, района, области, формулярные терапевтические комитеты
Принципы рационального применения ЛС ЭффективностьБезопасностьЭкономичностьСохранение и улучшение «Качества жизни»Увеличение выживаемости больных
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Оставленные комментарии видны всем.
Для продолжения скачивания необходимо пройти капчу:
Основные фармакокинетические параметры
Фармакокинетика — раздел клинической фармакологии, изучающий пути введения, биотрансформацию, связь с белками крови, распределение и выведение лекарственных средств (ЛС).
Один из основных показателей, определяющих фармакологический эффект, — концентрация ЛС в области рецептора, однако в условиях целостного организма установить её невозможно. Экспериментально доказано, что в большинстве случаев имеется корреляция между концентрацией препарата в крови и его содержанием в других биологических жидкостях и тканях.
Поэтому для определения фармакокинетических параметров ЛС изучают его содержание в крови. Чтобы получить соответствующие представления о поступлении препарата в кровь и выведении его из организма, определяют содержание ЛС в плазме крови в течение длительного времени, используя методы жидкостной или газожидкостной хроматографии, радиоиммунный и иммуноферментный анализы, спектрофотометрический метод. На основании полученных данных строят график (фармакокинетическую кривую), отмечая на оси абсцисс время исследования, а на оси ординат — концентрацию ЛС в плазме крови.
В связи со сложностью описания деталей процесса распределения ЛС во всех органах и тканях, организм условно представляют в виде одной или нескольких изолированных проницаемой мембраной частей (камер), в которых Л С распределяется. Этот вид моделирования называют камерным. За центральную камеру обычно принимают кровь и хорошо кровоснабжаемые органы (сердце, лёгкие, печень, почки, эндокринные железы), за периферическую — менее интенсивно кровоснабжаемые органы и ткани (мышцы, кожу, жировую ткань). В этих камерах ЛС распределяется с разной скоростью: быстрее — в центральной, медленнее — в периферической. К наиболее простым относят однокамерную модель, когда предполагают, что после введения препарата его концентрация убывает по моноэкспоненциальному закону. В соответствии с законами линейной кинетики скорость изменения количества препарата в камере пропорциональна его количеству в этой камере.
Кажущийся объём распределения (Vd) — гипотетический объём жидкости организма, необходимый для равномерного распределения всего количества ЛС (введённой дозы) в концентрации, аналогичной таковой в плазме крови. Этот показатель измеряют в л/кг. При внутривенном введении объём распределения равен отношению дозы ЛС к его начальной концентрации в крови.
• Высокие значения объёма распределения свидетельствуют о том, что ЛС активно проникает в биологические жидкости и ткани. При этом, если ЛС активно связывается, например, жировой тканью, его концентрация в крови может практически мгновенно стать очень низкой, а объём распределения достигнет нескольких сотен литров, превысив реальный объём жидкостей организма. Поэтому этот показатель и называют кажущимся объёмом распределения.
• Объём распределения зависит от различных факторов.
— Физико-химические свойства ЛС (молекулярная масса, степень ионизации и полярности, растворимость в воде и жирах) влияют на его прохождение через мембраны.
— Физиологические факторы (возраст, пол, общее количество жировой ткани в организме). Например, у пожилых людей и ново рождённых Vd снижен.
— Патологические состояния, особенно заболевания печени, почек, сердечно-сосудистой системы (ССС).
Максимальная концентрация (Сmax) и время наступления максимальной концентрации (Тmax). При поступлении ЛС в системный кровоток (в случае внесосудистого введения) его концентрация постепенно возрастает, достигая значения (Сmax) в момент Тmax, а затем начинает снижаться.
• Если процесс абсорбции имеет линейный характер (скорость процесса прямо пропорциональна количеству ЛС в системе), скорость этого процесса характеризуется константой абсорбции (kabs), измеряемой в часах и рассчитывается через период полувсасывания (Т1/2abs) — время, в течение которого всасывается 1/2 введённой дозы препарата.
Биодоступность (F) — часть дозы Л С (в %), достигшая системного кровотока после вне-сосудистого введения (в этом случае не всё количество препарата достигает системного кровотока).
• Абсолютную биодоступность определяют соотношением значений площади под кинетической кривой (area under curve, AUC) при вне-сосудистом и внутривенном введениях препарата.
— В рамках однокамерной модели при внутривенном введении площадь под кинетической кривой определяется отношением начальной концентрации в крови (Со) к константе элиминации (кеl)
— AUC прямо пропорциональна однократной дозе ЛС, введённой внутривенно (в/в), и обратно пропорциональна общему клиренсу препарата. Она связана с величиной объёма распределения:
где Vd — объём распределения, кеl — константа элиминации, D — доза, AUC — площадь под кинетической кривой.
• Биоэквивалентность (относительная биодоступность) — соотношение количества ЛС, поступившего в системное кровообращение при применении его в различных лекарственных формах или лекарственных препаратах, выпускаемых различными фирмами. Если сравниваемые ЛС аналогичны (действующее вещество, доза, лекарственная t форма), но изготовлены разными производителями, их называют дженериками, и в этом случае необходимо исследование их биоэкви— валентности. Два лекарственных препарата биоэквивалентны, если они обеспечивают одинаковую биодоступность ЛС.
Константа скорости элиминации (кеl) — процент снижения концентрации вещества в крови в единицу времени (отражает долю препарата, выводимую из организма за единицу времени). Элиминация складывается из процессов биотрансформации и экскреции. Константа скорости элиминации характеризует элиминацию в рамках однокамерной модели при линейном характере процесса выведения. Период полувыведения (Т1/2) — время, необходимое для снижения концентрации препарата в крови на 50% в результате элиминации. В рамках линейной модели Т1/2 рассчитывают по формуле:
• Практически за один Т 1 / 2 из организма выводится 50% ЛС, за два периода — 75%, за 3 периода — приблизительно 90% и т.д.
• Зависимость между Т1/2 и кеl важна для подбора режима дозирования и особенно для определения интервала между дозами.
Клиренс (CI) — объём плазмы или крови, полностью освобождающийся от ЛС в единицу времени. Этот показатель количественно характеризует выведение препарата и выражается в мл/мин или л/ч. В рамках линейной модели клиренс рассчитывают по формуле:
• Общий клиренс представляет собой сумму почечного и печёночного клиренсов (так как эти органы служат основными путями выведения ЛС). (Другие пути выведения или внепечёночный метаболизм при расчёте общего клиренса обычно не учитывают.)
— Печёночный клиренс характеризует биотрансформацию ЛС в печени (метаболический клиренс) и выведение с жёлчью (жёлчный клиренс).
— Почечный клиренс отражает выведение препарата с мочой. На пример, почечный клиренс циметидина приблизительно составляет 600 мл/мин, метаболический — 200 мл/мин, жёлчный — 10 мл/мин, поэтому общий клиренс равен 810 мл/мин.
• Основные физиологические факторы, определяющие клиренс, — функциональное состояние основных физиологических систем организма, объём притекающей крови и скорость кровотока в органе. Печёночный клиренс зависит от скорости печёночного кровотока или функциональной способности метаболизирующих ферментов. Например, клиренс лидокаина, интенсивно метаболизируемого печёночными ферментами, зависит прежде всего от скорости его доставки к печени (т.е. от объёма притекающей крови и скорости кровотока), поэтому, например, при застойной сердечной недостаточности он снижен. Клиренс же фенотиазинов зависит в основном от активности метаболизирующих ферментов, поэтому при поражении гепатоцитов клиренс препаратов этой группы резко снижается, вследствие чего концентрация их в крови значительно возрастает.
Равновесная (или стационарная) концентрация (Css) — концентрация, достигнутая при состоянии, когда в каждом интервале между приёмом очередных доз количество всасывающегося ЛС равно количеству элиминируемого [т.е. при стационарном (steady state), или равновесном, состоянии]. Т.е. если ЛС вводят в постоянной дозе через фиксированные интервалы времени, продолжительность которых меньше времени элиминации, его концентрация в крови возрастает, а затем колеблется в пределах средней величины между максимальными и минимальными значениями.
• При достижении С проявляется в полном объёме клинический эффект ЛС. Чем меньше Т1/2 ЛС, тем скорее достигается Си и тем выражение будут её колебания. Например, Т1/2 новокаинамида равен 2— 3 ч, и при назначении через каждые 6 ч его Css характеризуется большим разбросом значений. Поэтому для предупреждения и уменьшения колебаний Css в крови всё большее распространение получают лекарственные формы с замедленным высвобождением активного вещества.
В клинической практике фармакокинетические параметры используют, в частности, для расчёта назначаемых доз препаратов.
• Для расчёта нагрузочной дозы, требуемой для достижения необходимой эффективной концентрации ЛС в крови, используют объём распределения:
где Dнагр — нагрузочная доза, VD — объём распределения, С — концентрация ЛС в плазме крови.
• Для расчёта поддерживающей дозы, т.е. дозы, необходимой для поддержания нужной концентрации ЛС в крови, используют значение клиренса:
где Dnoд — поддерживающая доза, Сl — общий клиренс, Сss — равновесная концентрация.
К основным фармакокинетическим процессам относят всасывание, метаболизм (биотрансформацию), распределение и выведение ЛС.
При передозировке м/б побочные эффекты со стороны ссс Всасывание лс
Всасывание – процесс поступления ЛС из места введения в кровь
Зависит от пути введения, лекарственной формы (ЛФ), растворимости в липидах, скорости кровотока в месте введения.
Проходящие ч/з стенку ЖКТ – растворимость в липидах и степень ионизации
В/в, в/а – растворимость в воде
Всасывание – пассивная диффузия (липофильные ЛС)
фильтрация (гидрофильные ЛС)
Ка = const скорости абсорбции – скорость поступления ЛС в кровь из места введения
Т½ — период полуабсорбции – время необходимое для поступления в кровеносное русло ½ дозы ЛС из места ведения
О 
Факторы влияющие на всасывание лс

Отсюда степень и механизм всасывания электролитов определяется рН среды, в которую они попадают.
Слабая кислота в кислой среде проходит через биомембраны (запивать кислыми растворами, сразу после еды). Слабое основание – до еды за 1,5-2 часа или спустя 2 часа после, когда рН повысится (запивать щелочными растворами, молоком).
NB – нарушение кислотности ЖКТ и возрастные осбенности
рН желудка у детей 1го мес – 5,8
рН ниж отделов толст киш – 8,0
Кислоты всасываются лучше в желудке, основания в кишечнике.
Некоторые ЛС могут разрушаться в кислой среде (бензилпенициллин).
На всасывание ЛС оказывают влияние ферменты ЖКТ, которые способны расщеплять белки и полипептиды, снижая эффективность последних (АКТГ, инсулин).
Другие вещества (прогестерон, тестостерон, альдостерон, соли желчных кислот) могут ускорять всасывание или замедлять, образуя нерастворимые соли.
Часть принятой внутрь дозы ЛС, которая достигает системного кровотока в неизменном виде и в виде активных метаболитов, которые образовались при всасывании.
f – абсолютная биодоступность (БД) – часть дозы в процентах, которая достигает системного кровотока после внесосудистого введения
f’ – относительная БД – определяется с целью сравнения БД 2х ЛФ для внесосудистого введения
индивидуальные особенности организма
биофармацевитческие факторы ( ЛФ, технология производства, etc)
Распределение ЛС – накопление проникновение ЛС в разные органы и ткани
Степень накопления определяется биоэффективностью.
С0 – кажущаяся начальная концентрация – концентрация препарата, которая была бы достигнута в плазме крови при в/в введении и мгновенном распределении по органам и тканям
Css – стационарная концентрация – концентрация препарата, которая устанавливается в плазме крови при поступлении его в организм при постоянной скорости
Vd – объем распределения препарата – условный объем жидкости, к которой нужно растворить начальную дозу (D) вещества, чтоб полученная концентрация равнялась начальной
Если Vd 0,5 l/kg – ЛС распространено по всей водной фазе и в маловаскуляризированной ткани;
Vd > 1,0 l/kg – ЛС в мышцах и др. тканях.
Выбор пути введеня и дозирования препарта.
Характер распределения ЛС характеризуется:
интенсивностью регионарного кровотока
степенью связывания ЛС с белками плазмы крови и тканевыми структурами
растворимостью в липидах
Большая часть препаратов в первые минуты после всасывания попадают в хорошо кровоснабжаемые органы: почки, легкие, мозг, надпочечники, щитовидную железу, печень, сердце, селезенку; потом в мышцы, слизистые, кожу, жировую ткань, кости.
Гидрофильные в-ва имеют малый Vd.
Гидрофилы (Н2-блокаторы) плохо проникают в мозг.
Липофильные (Диметоксин) – хорошо => выраженность эффекта
Распределение ЛС в организме связано со степенью связывания с белками плазмы крови.
Чем выше степень –тем меньше ЛС накапливается в тканях. Терапевтический эффект создается медленнее и на большее время, и наоборот…
Элиминация – процесс удаленя ЛС из организма путем биотрансформации (БТ) и экскреции
Различают – пресистемную (до системы печени)
– системную (удаление ксенобиотика после попадания в системный кровоток)
Kel – const elimination – скорость исчезновения ЛС из организма путем БТ и выведения
Kex – const excretion speed – скорость выведения ЛС с мочой, калом, др. биожидкостями.
Clt – объем плазмы крови, очищающийся от ЛС за единицу времени, измеряемую в миллилитр/минута, за счет выведения почками, печенью, др органами, т.е. это сумма почечного (renalis=r) и печеночного клиренсов (Cl).
D 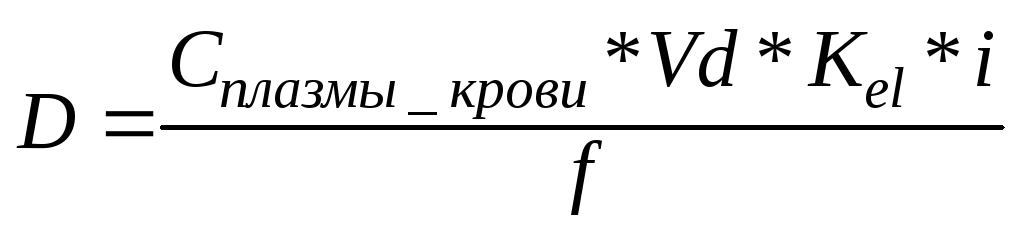
300D, выделяющиеся с желчью, в кишечнике гидролизируются, всасываются в кровь и попадают в печень, а затем экскретируются с желчью – энтерогепатическая циркуляция
Фильтрация – зависит от М в-ва и фильтрируется то, что не связано с белками крови. О скорост судят по креатинину.