egfr что это такое
Определение мутации в генах EGFR и V600 BRAF
Каждая клетка организма подчиняется определенным законом и выполняет отведенные ей функции. Работа клеток программируется генетическим кодом, молекулы и белки регулируют жизнь клеток, обеспечивая бесперебойное функционирование организма. Однако в любом механизме могут происходить поломки, и наши гены – не исключение. Сегодня мы расскажем о мутациях в генах EGFR и BRAF. Тестирование на эти мутации помогает онкологам назначать эффективное лечение пациентам со злокачественными новообразованиями.
Биологические функции гена EGFR?
Ключевое свойство любой опухоли — это нарушение баланса между клеточным делением, т.е. размножением клеток, и клеточной гибелью. Для того, чтобы процесс деления осуществлялся в норме, необходимо поступление верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Например, фактором роста может выступать белок EGF (Epidermal Growth Factor ‒ перевод «эпидермальный фактор роста»). EGF и другие белки способны стимулировать рост и деление различных клеток.
Белок EGF взаимодействует с соответствующим рецептором на мембране (оболочке) клетки — EGFR (epidermal growth factor receptor). Белок подает «команду» рецептору, в результате внутри клеток запускается последовательность биохимических реакций и клетки начинают делиться. Рецептор EGFR кодируется геном EGFR. Если в гене EGFR есть мутация, то изменяется структура рецептора. Рецептору больше не нужно взаимодействовать с ростовым фактором, т.е. ему больше не нужна «команда» для активации. Вследствие этого в клетках с мутацией сигналы к делению передаются непрерывно, клетки начинают активно делиться и происходит рост опухоли, а также усиление процессов инвазии (прорастания в окружающие ткани), патологического ангиогенеза (образования новых сосудов в опухоли) и метастазирования.
Открытие мутаций в гене EGFR при раке легкого стало одним из важнейших событий в онкологии. Повышенное количество данного белка наблюдается при многих видах рака. С учетом этого факта ученые и медики разрабатывали ингибиторы – вещества, которые подавляют или задерживают течение физиологических или физико-химических процессов. Ожидалось, что эти препараты могут стать «универсальным лекарством против рака». Однако на практике у пациентов редко наблюдались объективные ответы на ингибитор EGFR гефитиниб, т.е. терапия редко оказывала ожидаемый эффект. При этом для малого количества пациентов лечение было эффективным. Врачи выяснили, что опухоли этих пациентов содержали в своём геноме ранее неизвестные мутации в гене EGFR.
Таким образом стало понятно, что именно мутированный белок EGFR является мишенью препарата, и что перед назначением молекулярных ингибиторов EGFR должно проводиться молекулярно-генетическое тестирование. Существует несколько вариантов мутаций EGFR, две из них встречаются наиболее часто – Del19 и L858R. Они встречаются в 15-20% немелкоклеточных неплоскоклеточных опухолей легкого, наиболее часто – в аденокарциномах.
В каких случаях нужно сделать тест на мутацию EGFR?
Тест на мутации в гене EGFR позволяет онкологу принять решение о назначении пациенту с местно-распространенным или метастатическим немелкоклеточным раком легкого терапии низкомолекулярными ингибиторами EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб и т.д.). Тест целесообразно назначать только тем пациентам, у которых обнаружена аденокарцинома лёгкого или другая разновидность немелкоклеточного неплоскоклеточного рака. Помимо этого, EGFR-тестирование рекомендуется всем пациентам с местно-распространенным или метастатическим, плоскоклеточным раком лёгкого, которые либо являются женщинами, либо не имеют анамнеза длительного и/или интенсивного курения.
Что делать, если в опухоли лёгкого обнаружена мутация в гене EGFR?
Идентификация мутации в гене EGFR в опухоли является основанием для назначения низкомолекулярных ингибиторов EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб). Положительный эффект от лечения наблюдается практически у каждого пациента с мутацией EGFR.
Биологические функции гена BRAF
Процесс деления клеток в норме происходит при поступлении верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Они прикрепляются к определённым рецепторам на поверхности клеточной оболочки и запускают внутри клетки ряд последовательных биохимических реакций. Результатом становится производство и накопление внутри клетки белков, которые необходимы для дальнейшего деления.
Белок BRAF принимает участие в описанной выше сигнальной цепи EGFR. В норме BRAF активируется только при поступлении сигнала от расположенного «выше» по цепи белка. А мутации BRAF могут привести к автономной активации процесса деления клетки, т.е. клетки начинают размножаться без «команды» организма.
Наиболее частый тип мутации – это замена 600-ой по счету аминокислоты валин (V) в структуре белка на глутаминовую кислоту (E) (BRAF V600E).
Мутации BRAF встречаются при самых разных типах рака, чаще всего – при меланоме (40-60%), реже – при раке толстой кишки (5-10%), немелкоклеточном раке легкого (2-3%) и др. Помимо этого, генетические дефекты BRAF характерны для редкого онкогематологического заболевания – волосатоклеточного лейкоза (90-100%).
Открытие мутаций гена BRAF привело к созданию низкомолекулярных ингибиторов мутированного фермента BRAF (вемурафениб, дабрафениб). Эти препараты блокируют сигнальную цепочку, которую активирует мутация BRAF, и таким образом держивают рост опухоли.
В каких случаях нужно сделать тест на мутацию V600 BRAF?
Тестирование мутаций в гене BRAF необходимо для выбора тактики лечения при неоперабельной/метастатической меланоме кожи, распространенном немелкоклеточным раке легкого и раке толстой кишки. Присутствие мутации является необходимым условием для назначения ингибиторов BRAF (вемурафениб, дабрафениб). При раке толстой кишки наличие мутации BRAF свидетельствует о необходимости использования комбинации BRAF- и EGFR-ингибиторов.
В настоящее время определение мутаций V600 BRAF в биопсийном производится при диагнозах «меланома кожи и слизистых оболочек», «рак прямой кишки», «рак ободочной кишки и ректосигмоидного отдела», «волосатоклеточный лейкоз»
Как сдать анализ на мутации в гене EGFR и BRAF?
Материалом для молекулярно-генетического тестирования являются опухолевые клетки. В качестве источника опухолевых клеток можно использовать как биопсийный материал, так и опухоль, удалённую в ходе хирургической операции.
В ходе первичного обследования онкологическому пациенту практически всегда выполняют биопсию, на основании которой происходит патоморфологическое подтверждение диагноза. Для этого каждый биоптат проходит многоэтапную химическую обработку, в результате которой создаётся специальный парафиновый блок. С одной стороны, это необходимо для получения качественного тонкого среза (толщиной 5 мкм) с целью патоморфологической диагностики. С другой стороны, в правильно подготовленном парафиновом блоке молекулы ДНК надёжно сохраняются на протяжении десятилетий. Эти же процедуры выполняются в отношение опухолевых тканей, удалённых в ходе операции. Правильное выполнение процедуры фиксации позволяет использовать образцы опухолей для молекулярно-генетического исследования ДНК спустя месяцы и годы после заливки образца в парафин.
Идеальным набором для молекулярно-генетического исследования является следующий комплект: парафиновый блок c тканью опухоли и одно стекло, окрашенное гематоксилином и эозином (всё перечисленное хранится в патологоанатомических архивах медицинских учреждений, а окраска гематоксилином и эозином – основная окраска, используемая в современной патоморфологической диагностике). Если медицинское учреждение по какой-либо причине не может предоставить блоки, то для молекулярно-генетического тестирования достаточно 5-10 неокрашенных срезов ткани опухоли на непокрытых стёклах толщиной 3-5 мкм и одно стекло, окрашенное гематоксилином и эозином.
Кроме того, для молекулярно-генетического исследования пригодны опухолевые клетки, полученные в результате цитологического исследования (мазки, цитоспины, цитоблоки). Для проведения теста необходимо, чтобы в препарате присутствовало не менее 200 (!) опухолевых клеток. Тип окрашивания (по Папаниколау, Романовского-Гимза, Лейшмана, Май-Грюнвальд и т.д.) не влияет на сохранность нуклеиновых кислот.
Требования к упаковке материала перед транспортировкой
В настоящее время многие молекулярно-диагностические исследования выполняются за счет средств территориальных фондов ОМС регионов России
Авторская публикация:
Иванцов Александр Олегович
доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Egfr что это такое
Определение мутации гена EGFR в тканях опухолей – молекулярно-генетическое исследование биоптата опухолевой ткани, позволяющее выявить наличие определенных мутаций в гене рецептора эпидермального фактора роста, играющих роль в злокачественной трансформации.
EGFR Mutation Testing, Epidermal Growth Factor Receptor Mutation Analysis, HER-1, erbB-1.
Какой биоматериал можно использовать для исследования?
Образец ткани (в парафиновом блоке).
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Современные успехи в лечении онкологических заболеваний во многом связаны с обнаружением молекулярных механизмов возникновения и развития злокачественных новообразований, отличающих их от клеток нормальных тканей, и появлением лекарственных препаратов, способных воздействовать на них. Такие лекарства называются таргетными, то есть действующими на определенную «цель» в опухолевой клетке. Они обладают хорошим профилем безопасности, так как, в отличие от стандартной химиотерапии, практически не действуют на нормальные ткани и характеризуются большей эффективностью. Однако назначение таргетных препаратов возможно лишь при обнаружении в опухолевых клетках специфической мишени для их действия.
Материалом для исследования служит ДНК опухолевых клеток. Она может быть выделена из биоптата опухоли, находящегося в парафиновом блоке. Если же на исследование предоставлен образец опухоли в емкости с фиксирующим раствором, из него изготавливаются парафиновые блоки для возможности длительного хранения и использования в последующем для других диагностических тестов.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Отрицательный результат – мутации не обнаружены.
Что может влиять на результат?
Нарушение техники фиксации биопсийного материала, которое может привести к деградации генетического материала и невозможности тестирования.
Цитологическое исследование материала, полученного при оперативном вмешательстве
Цитологическое исследование материала, полученного при эндоскопии (бронхоскопия)
Гистологическое исследование биопсийного материала
Гистологическое исследование биоптата лимфатического узла (1 узел) с использованием рутинных методик окраски
Определение мутации гена BRAF в тканях опухолей
Определение перестройки гена ALK при раке легкого методом ИГХ
Кто назначает исследование?
Henry’s Clinical Diagnosis and Management by Laboratory Methods, 23e by Richard A. McPherson MD MSc (Author), Matthew R. Pincus MD PhD (Author). St. Louis, Missouri : Elsevier, 2016. Pages 1500-1501.
The Basic science of Oncology. Fifth edition. Ian F. Tannock, Robert G. Bristow, Richard P. Hill, Lea Harrington. McGrow-Hill Education, 2013. Pages 173-179.
Программа RUSSCO «Совершенствование молекулярно-генетической диагностики в российской федерации». Практическое руководство для врачей. www.cancergenome.ru
Доклад «Современные возможности таргетной терапии НМРЛ», Имянитов Е. Н. Вестник московского онкологического общества, №11 (602), 2013. С. 3-6.
Мутация EGFR – это хорошо или плохо?
Когда в 1962 году американский ученый обнаружил в экстракте слюнной железы мышей сложное вещество, эпидермальный фактор роста (EGF), состоящий из более чем пяти десятков аминокислот, он и не представлял, что сделал первый шаг к большому открытию, которому будет суждено изменить представление о раке легкого. Но лишь в начале XXI века станет достоверно известно, что мутации рецептора, с которым связывается EGF, могут становиться отправной точкой в развитии одной из самых агрессивных опухолей – рака легкого.
Что такое эпидермальный фактор роста?
Следует отметить, что EGF – белок, необходимый нашему организму. Так, находящийся в слюнных железах эпидермальный фактор роста обеспечивает нормальный рост эпителия пищевода и желудка. Кроме того, EGF содержится в плазме крови, моче, молоке.
Свою работу EGF выполняет, связываясь с рецептором эпидермального фактора роста, EGFR, расположенным на поверхности клеток. Это приводит к активации ферментов тирозинкиназ, которые и передают сигнал о необходимости активной деятельности. В результате происходят несколько последовательных процессов, в том числе увеличение скорости выработки белков и синтез молекулы, которая обеспечивает хранение и реализацию программы развития живых организмов, ДНК. Итогом этого и становится деление клеток.
В 90-х годах прошлого века стала очевидна роль рецептора эпидермального фактора роста как онкогена, играющего одну из ведущих ролей в развитии ряда злокачественных заболеваний.
Эпидермальный фактор роста и рак
В конце XX века было проведено несколько исследований, подтверждающих значение EGF в развитии злокачественных заболеваний. В 1990 году американские ученые доказали, что блокирование связывания эпидермального фактора роста с рецепторами и, как следствие, предотвращение активации фермента тирозинкиназы останавливает рост злокачественных клеток [1].
Конечно, далеко не у всех и не всегда эпидермальный фактор роста «запускает» процессы ненормируемого деления клеток. Чтобы нормальный белок, необходимый для жизнедеятельности нашего организма, вдруг стал его злейшим врагом, в молекуле рецептора эпидермального фактора роста должны произойти генетические изменения, или мутации, которые приводят к многократному увеличению числа рецепторов EGF – их гиперэкспрессии.
Причиной мутаций могут быть потенциально агрессивные факторы окружающей среды, например, токсины, а также курение, поступление канцерогенных веществ с пищей. В некоторых случаях «поломки» в рецепторе эпидермального фактора роста накапливаются на протяжении нескольких поколений, передаваясь от родителей детям. Тогда говорят о наследственных мутациях.
Следует отметить, что «поломки» в молекуле рецептора эпидермального фактора роста связаны с несколькими видами рака. Прежде всего, это немелкоклеточный рак легкого (НМРЛ). Гораздо реже мутации и, как следствие, гиперэкспрессия EGFR приводят к развитию опухолей шеи, головного мозга, толстой кишки, яичника, шейки матки, мочевого пузыря, почки, молочной железы, эндометрия.
Есть ли у вас мутация эпидермального фактора роста?
У некоторых категорий больных вероятность «поломки» значительно повышена. Так, известно, что мутация рецептора эпидермального фактора роста гораздо чаще происходит у людей, которые никогда не курили. Это вовсе не означает, что приверженцы табакокурения реже болеют раком легкого – напротив, известно, что вредная привычка становится причиной развития заболевания в 90% случаев. Просто у курильщиков рак легкого развивается по другому механизму.
Показательные результаты, отражающие распределение мутаций эпидермального фактора роста среди россиян, были получены в одном крупном отечественном исследовании, в котором были изучены данные более 10 тысяч больных раком легкого [2]. Они показали, что мутации EGFR обнаруживались:
Кроме того, в исследовании было выявлено, что вероятность появления «поломки» в рецепторе эпидермального фактора роста увеличивается у больных аденокарциномой с возрастом, вырастая от 3,7% в 18-30 лет до 18,5% в 81-100 лет.
Результаты зарубежного исследования, в котором участвовали более 2000 больных аденокарциномой легкого [3], показали, что мутация EGFR была выявлена:
Эти данные подтверждают: мутации рецептора эпидермального фактора роста могут быть обнаружены и у тех, кто не представляет жизни без сигареты, просто гораздо реже, чем у приверженцев здорового образа жизни.
Несмотря на вполне однозначную тенденцию распространения «драйвер-мутации» EGFR, точный ответ на вопрос, есть ли эта «поломка» у вас, можно получить только по результатам молекулярно-генетического тестирования, которое проводят всем больным раком легкого.
Если у вас обнаружена мутация EGFR
Еще каких-то десять лет назад у половины больных раком легкого было гораздо меньше шансов успешно бороться с опухолью. Однако сегодня стали доступны препараты, которые позволили в корне изменить эту ситуацию. Речь идет о таргетной терапии, которая стала доступной в последнее десятилетие.
Наличие мутации эпидермального фактора роста, подтвержденное результатами молекулярно-генетического исследования, предоставляет онкологам возможность ввести в схему лечения таргетные препараты. Создание таргетных лекарственных средств для лечения рака легкого стало прорывом в современной онкологии.
Таргетные препараты действуют на первопричину злокачественного заболевания, влияя на сам механизм, запускающий неограниченный клеточный рост и деление. Они блокируют фермент тирозинкиназу, которая передает сигнал к «началу боевых действий» и, собственно, активирует процессы размножения и роста клеток.
Таргетная терапия рака позволяет значительно отдалить его прогрессирование, в том числе и по сравнению со стандартной химиотерапией. Это – значимое преимущество таргетных лекарств.
Способность таргетных препаратов (ингибиторов тирозинкиназы EGFR) продлевать время до прогрессирования опухоли была доказана в крупном анализе, изучающем результаты 23 исследований, в которых участвовало более 14 тысяч больных немелкоклеточным раком легкого с мутацией рецептора эпидермального фактора роста [6].
Важно отметить, что при наличии мутации EGFR лечение рака, как правило, не исчерпывается только таргетными препаратами. Вы должны быть готовым к сложной, длительной и комплексной терапии, в том числе оперативному вмешательству, лучевой терапии и др.
Если у вас не обнаружена мутация EGFR
Отрицательный результат молекулярно-генетического анализа на мутацию EGFR еще не говорит о том, что таргетная терапия вам не поможет. Прежде всего, важно выяснить, обнаружены ли в вашей опухоли какие-либо другие «поломки». Хотя мутация рецептора эпидермального фактора роста является самой распространенной среди больных раком легкого, не исключена вероятность и других, более редких «ошибок».
В современных протоколах, на которые опираются онкологи при подборе индивидуальной схемы лечения НМРЛ, настоятельно рекомендуют проводить развернутый молекулярно-генетический анализ для выявления не только самых распространенных «драйвер-мутаций», но и редких «поломок». Современный выбор таргетных препаратов позволяет подобрать «целевое» лекарство для большинства известных мутаций при раке легкого.
Если же в образце вашей опухоли не было обнаружено ни одной генетической «ошибки», таргетная терапия вам действительно не показана. Препараты, которые созданы для того, чтобы попадать «в яблочко», бесцельно не принимают, поскольку они просто не будут работать. Но у онкологов есть и другие терапевтические возможности, которые в вашем случае будут эффективны: это химиотерапия и, возможно, иммунотерапия. И все же вы должны помнить – индивидуальную схему лечения будет определять ваш лечащий врач, опираясь на данные о гистологическом типе вашей опухоли, стадии заболевания и др.
При копировании материалов
ссылка на сайт обязательна.
Материалы конгрессов и конференций
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ИНГИБИТОРЫ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА (EGFR)
Д.А. Носов
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
В настоящее время огромное число фундаментальных исследований сфокусировано на поиске новых рациональных подходов к противоопухолевой терапии. Понимание молекулярных механизмов, ответственных за митогенную активность трансформированных клеток, открывает новые пути контроля опухолевого роста. Одним из объектов, активно изучаемых в последние годы в качестве новой противоопухолевой мишени, является рецептор эпидермального фактора роста (EGFR).
EGFR экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток и участвует в регуляции клеточного роста и дифференцировки. Как и все рецепторные тирозинкиназы, EGFR состоит из трех участков: внеклеточный лиганд-связывающий домен, трансмембранный гидрофобный участок и внутриклеточный тирозинкиназный домен (рис. 1).
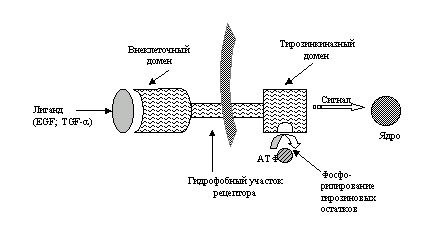
Рис. 1. Схематическое строение EGFR.
В роли лигандов выступают экскретируемые нормальными и/или опухолевыми клетками ростовые факторы EGF и TGF-a, которые аутокринным и/или паракринным путем регулируют активность рецептора эпидермального фактора роста. Активация EGFR происходит после связывания одного из специфичных лигандов с внеклеточным доменом, последовательных конформационных изменений в виде димеризации рецептора и реакции фосфорилирования тирозиновых остатков внутриклеточного домена.
На этапе взаимодействия с факторами роста существует возможность не только гомодимеризации EGFR, т.е. образования двух идентичных рецепторов EGFR связанных с общим лигандом, но может произойти и гетеродимеризация EGFR с другими представителями семейства erbB, в частности с рецептором Her2/neu и erB3. Образование гетеродимера приводит к значительному усилению внутриклеточных сигнальных импульсов.
В результате всех этих взаимодействий активированная тирозинкиназа через специальные белки запускает целый каскад внутриклеточных процессов, передающих импульс к ядру клетки и, тем самым, инициирует клеточную пролиферацию и ряд других биологических эффектов, ответственных за опухолевую прогрессию: адгезию и инвазию трансформированных клеток, включение антиапоптотических механизмов (1). Более того, TGF-a и EGF могут индуцировать процессы опухолевого ангиогенеза за счет гиперэкспрессии васкулярного эндотелиального фактора роста (VEGF) (1,2).
Таким образом, можно выделить следующие основные механизмы активации EGFR-зависимых сигнальных путей в опухолевых клетках: 1) гиперэкспрессия EGFR, 2) избыточная продукция факторов роста (TGF-a, EGF), 3) мутация EGFR и, как следствие этого, его повышенная активность при отсутствии факторов роста, 4) гетеродимеризация рецептора.
При ряде опухолей эпителиальной природы (раке легкого, яичников, толстой кишки, предстательной железы, плоскоклеточном раке головы и шеи) обнаруживается избыточная экспрессия EGFR и/или одного из его лигандов (EGF; TGF-a), что может служить причиной повышенной пролиферативной активности трансформированных клеток (3,4). Гиперэкспрессия EGFR опухолевыми клетками, как правило, ассоциируется с поздними стадиями и метастатическим фенотипом заболевания и, соответственно, коррелирует с плохим прогнозом (5).
Таблица 1.
Экспрессия EGFR различными видами опухолей.
| Тип опухоли | Частота экспрессии EGFR |
|---|---|
| Немелкоклеточный рак легкого | 40%-80% |
| Рак толстой кишки | 25%-77% |
| Рак желудка | 33% |
| Рак яичников | 35%-70% |
| Рак молочной железы | 15%-30% |
| Рак предстательной железы | 40% |
В итоге, выбор EGFR в качестве противоопухолевой мишени выглядит вполне обоснованным и логичным. Помимо этого, результаты экспериментальных исследований указывают на возможность усиления цитотоксического действия других противоопухолевых агентов: платиновых производных, доксорубицина, гемцитабина и таксанов при сочетании последних с ингибиторами EGFR (6,7,8). Интересно, что наблюдаемый в этих случаях противоопухолевый синергизм не требует повышенного уровня экспрессия EGFR.
Представляется также, что эффективность терапии ингибиторами EGFR должна оцениваться в большей степени с точки зрения отдаленных, чем непосредственных результатов лечения.
Существует несколько возможностей блокирования реализуемого через EGFR биологического эффекта:
На протяжении последних 15 лет все эти подходы интенсивно разрабатываются в эксперименте с целью поиска новых потенциальных противоопухолевых агентов и внедрения их в клиническую практику. Результатом этого поиска явился синтез таких препаратов как цетуксимаб (С225), иресса (ZD1839) и OSI-774, которые активно изучаются уже в рамках II и III фаз клинических исследований.
Цетуксимаб (С225) представляет собой рекомбинантое химерное моноклональное антитело, обладающее высокой специфичностью к внеклеточному домену EGFR и, соответственно, способное конкурировать с естественными лигандами (EGF; TGF-a) за связывание с рецептором. Препарат синтезирован на основе мышиного моноклонального антитела М225, к которому для снижения иммуногенности присоединили фрагмент человеческого IgG1.
Результаты клинических исследований, проведенных в рамках I фазы и представленных в 2000 г. на ASCO, выглядят многообещающими (таблица 2). Дизайн этих исследований был нацелен на изучение переносимости препарата, фармакокинетических параметров и поиск оптимальной дозы цетуксимаба. Одним из критериев включения являлось наличие гиперэкспрессии EGFR опухолевой тканью, определяемой иммуногистохимическим методом на парафиновых блоках.
Токсичность терапии была незначительной и в основном проявлялась в виде лихорадки, астении, повышении уровня трансаминаз и кожных реакций (угревидной сыпи). За исключением кожной, другие виды токсичности не зависели от разовой и/или суммарной дозы С225. Всего у одного больного на фоне терапии выявлено повышение титра анти-С225 антител.
Таблица 2.
Результаты I фазы клинических исследований по изучению цетуксимаба.
Rubin et al. (10) на небольшой группе больных (8 чел.), ранее уже получавших противоопухолевую лекарственную и/или лучевую терапию, также продемонстрировали хорошую переносимость и потенциальную эффективность комбинации С225+цисплатин и С225+иринотекан.
Кроме того, благодаря своей низкой молекулярной массе препараты обладают хорошей проникающей способностью и, что не менее важно, удобны в применении, поскольку назначаются per os.
ZD1839 (Иресса). Препарат синтезирован в лаборатории компании Astra Zeneca. В ходе одного из первых клинических исследований I фазы монотерапия ZD1839 в режиме эскалации дозы от 50 до 700 мг/сутки при минимальной токсичности продемонстрировала убедительную противоопухолевую эффективность в основном у больных немелкоклеточным раком легкого, ранее леченых с помощью стандартных химиотерапевтических подходов (14). Частичные ремиссии (2-9+ мес.) отмечены у 4 (25%) из 16 пациентов и еще в 2 (12%) случаях наблюдались стабилизации (5-5+ мес.). Дозолимитирующим видом токсичности являлась диарея 3 ст., зафиксированная в 3% случаев при использовании максимальной дозы 700 мг/сутки.
Несмотря на то, что объективного эффекта удалось добиться только у 2 пациентов (немелкоклеточный рак легкого и рак предстательной железы), частота минимальных эффектов (3 больных) и стабилизаций заболевания продолжительностью более 3 мес. (29 больных) приближалась к 41%. Минимальная доза препарата, при которой регистрировались ремиссии, составляла 150 мг/сутки. На данном этапе, ориентируясь на результаты 6 клинических исследований I фазы, в которые в общей сложности включены более 300 больных, можно сделать вывод о том, что биологически эффективная доза препарата значительно ниже максимальной переносимой дозы и колеблется от 250 мг до 500 мг.
Успешное завершение I/II фазы клинических исследований позволило инициировать рандомизированные плацебо контролируемые многоцентровые исследования в рамках III фазы по изучению роли ZD1839 в наиболее активных химиотерапевтических комбинациях (гемцитабин/цисплатин и паклитаксел/карбоплатин) у больных немелкоклеточным раком легкого. В предстоящем сравнительном анализе выживаемость больных будет являться основным показателем, определяющим эффективность того или иного лекарственного подхода.
Рассматриваются также возможности комбинированного применения герцептина и ирессы у больных раком молочной железы при одновременной экспрессии опухолью EGFR и Her2/neu, которая может встречаться в 10-36% случаев (5). Для этого подхода имеются свои предпосылки. Во-первых, доклинические исследования показывают, что трастузумаб не снимает EGF индуцированную активность рецептора эпидермального фактора роста (16), во-вторых, сочетание двух препаратов сопровождается более выраженным угнетением пролиферативной активности опухолевых клеток in vitro (17).
N. Senser et al. приводят данные о 114 пациентах, получавших лечение OSI-774 в связи с рецидивом плоскоклеточного рака головы/шеи после индукционной химиотерапии первой линии (18). Как и при использовании ZD1839, наиболее часто встречаемыми токсическими осложнениями, носящими обратимый характер, являлись кожная сыпь, диарея, тошнота, рвота и слабость. Редукция дозы препарата потребовалась в 21% случаев. На данном этапе эффективность лечения оценена у 78 пациентов. Частичная ремиссия зарегистрирована у 13%, стабилизация у 29% больных. В скором времени авторы приведут данные о влиянии на результаты лечения исходного уровня экспрессии EGFR опухолевой тканью.