Лимфосумма клеточный иммунитет что означает
Лимфосумма клеточный иммунитет что означает
Тест предназначен для оценки Т-клеточного иммунитета к СOVID-19. Позволяет выявить в крови специфические Т-клетки (Т-лимфоциты), реагирующие на определенные антигены коронавируса SARS-CoV-2. Такие специфические Т-лимфоциты способны узнавать и уничтожать пораженные вирусом клетки и могут потенциально обеспечивать долгосрочную защиту от COVID-19, в том числе при отсутствии антител. Оценка Т-клеточного иммунитета наряду с гуморальным (определение антител) может использоваться как дополнительный маркер иммунной защиты от COVID-19.
Используется технология ELISPOT, которая является наиболее перспективной на сегодняшний день платформой для оценки Т-клеточного иммунитета.
Синонимы русские
Т-клети, Т-лимфоциты к коронавирусу.
Синонимы английские
T-cell immunity to COVID-19.
Прямая оценка функции Т-клеток ELISPOT.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Общая информация об исследовании
Пандемия SARS-CoV-2 привела к гибели более 2 миллионов человек на сегодняшний день, и существует острая потребность в эффективной вакцине. Есть значительный интерес к пониманию того, насколько адаптивные иммунные реакции контролируют острую инфекцию и обеспечивают защиту от повторного заражения.
Антительные ответы против SARS-CoV-2 характеризуются реакцией против ряда вирусных белков, включая спайковые белки, нуклеопротеины и мембранные белки. Уровни антител снижаются после избавления от первичной инфекции, и в настоящее время актуален вопрос о поддержании гуморальных ответов в долгосрочной перспективе. Хотя первоначальные анализы показали потерю выявляемых вирус-специфических антител у части людей, высокочувствительный ИФА может определять обнаруживаемые антитела в течение как минимум 6-7 месяцев у большинства людей. Данные, полученные в результате исследования иммунитета к родственным вирусам, таким как SARS-CoV-1 и ближневосточный респираторный синдром, свидетельствуют о том, что клеточные иммунные ответы против этих вирусов поддерживаются в течение более длительных периодов по сравнению с ответами антител. Это позволяет надеяться, что клеточные реакции на SARS-CoV-2 также будут более продолжительными. На сегодняшний день исследования показали, что вирус-специфические клеточные реакции развиваются практически у всех пациентов с подтвержденной инфекцией SARS-CoV-2.
Величина и качество ответа иммунной памяти к SARS-CoV-2 будет иметь решающее значение для предотвращения повторного заражения.
Величина ответа Т-клеток является неоднородной и может отражать разнообразие профиля Т-клеточного иммунитета во время острого инфекционного заболевания. Важной особенностью является то, что величина клеточного иммунитета по данным ELISPOT на 50 % выше у доноров, перенесших симптомную инфекцию. Это демонстрирует, что первоначальная «контрольная точка» клеточного иммунитета, выработанная после острой инфекции, сохраняется не менее 6 месяцев. Клеточные ответы имеют прямую защитную способность от тяжелой коронавирусной инфекции, а также поддерживают выработку антител.
Исследования показывают, что устойчивый клеточный иммунитет против SARS-CoV-2 может присутствовать в подавляющем большинстве случаев у взрослых через 6 месяцев после бессимптомной инфекции или легкой и средней степени тяжести инфекционного заболевания. Эти особенности обнадеживают в отношении длительности клеточного иммунитета против этого нового вируса и, вероятно, способствуют относительно низкому риску повторного заражения.
Анализ на Т-клеточный иммунитет проводится методом ELISPOT, который имеет ряд преимуществ:
проверенная технология обнаружения активных Т-клеток для измерения силы иммунного ответа на инфекцию;
технология ELISPOT в настоящее время является уникальной в мире;
ELISPOT широко используется исследователями разных стран при разработке вакцин от COVID-19;
ELISPOT является наиболее перспективной платформой среди методов оценки Т-клеточного иммунного ответа:
к определенным Т-лимфоцитам добавляют белки вируса;
если Т-лимфоциты и вирусы раньше встречались, то они выделяют цитокины;
если спотов больше 12 – это означает, что иммунитет есть.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Панель антигенов 1 (пептиды белка S), SPOT:
Панель антигенов 2 (пептиды белков N, M, O3, O7), SPOT:
положительный результат может потенциально свидетельствовать о перенесенной или текущей инфекции COVID-19, в том числе бессимптомно, и о сформировавшемся Т-клеточном иммунном ответе к вирусу SARS-CoV-2.
У большинства переболевших, у которых не выявляются антитела, есть Т-клеточный ответ. Люди без антител, контактировавшие с больными и не заболевшие, также в большинстве своем имеют Т-лимфоциты.
Кто назначает исследование?
Терапевт, врач общей практики.
Иммунная система Часть 8 Анализы
Иммунная система Часть 8 Анализы
Помимо поражения вирусом иммунодефицита человека, вторичный иммунодефицит развивается после объемных оперативных вмешательств, обширных, тяжелых инфекций, на фоне терапии иммуноподавляющими или сильными противовоспалительными препаратами.
Исследования иммунитета помогают в оценке активности и стадии воспалительного, инфекционного и аллергического иммунного ответов, эффективности проводимой терапии. С этой целью они проводятся неоднократно.
Клинический анализ крови с лейкоцитарной формулой
Клинический анализ крови с лейкоцитарной формулой позволяет выявить множество заболеваний. Он отражает состояние гемопоэза – созревания и роста клеток крови в костном мозге. О состоянии иммунной системы говорят уровни белых клеток крови – лейкоцитов и лейкоцитарная формула. Наблюдение за лейкоцитарной формулой в динамике заболевания позволит выявить осложнения, распространение инфекции по организму, реакцию на лечение.
При бактериальных инфекциях можно увидеть повышение лейкоцитов и нейтрофилов с появлением их молодых форм в крови.
При вирусных инфекциях, наоборот, лейкоциты снижаются, а в лейкоцитарной формуле преобладают лимфоциты.
Преобладание тех или иных популяций в лейкоцитарной формуле помогает в диагностике причины воспаления. Например, при определенных инфекциях (например, инфекционный мононуклеоз) нарастают измененные моноциты, а при аллергических и паразитарных заболеваниях – эозинофилы.
Наличие совсем юных клеток (бластов) в крови признак чрезмерной активации костного мозга, а низкий уровень лейкоцитов и нейтрофилов без воспаления – его угнетения.
Лимфоциты, иммунофенотипирование
Выделяют разные популяции лимфоцитов, которые играют ключевую роль в направлении иммунного ответа – клеточный или гуморальный. Определение иммунного фенотипа лимфоцита возможно в специальном исследовании методом проточной цитофлюориметрии. Фенотип лимфоцитов зависит от особых рецепторов на их поверхности – кластеров дифференцировки CD. Наличие того или иного рецептора свидетельствует о принадлежности клетки к определенной популяции лимфоцитов.
Т-лимфоциты (CD3+) общие и их подтипы:
Т- клетки-киллеры (CD3+CD16+CD56+)
Естественные клетки-киллеры (CD3-CD16+CD56+)
Лимфоциты с маркером HLA-DR+
Иммунорегуляторный индекс (Т-хелперы/Т-цитотоксические)
Дополнительно исследуют другие CD маркеры лимфоцитов для определения их активности.
Циркулирующие иммунные комплексы и система комплемента
Антигены связываются специфическими антителами с образованием иммунных комплексов. Последние активируют комплемент, способствуют удалению чужеродных антигенов. Если их слишком много циркулирует в крови, они откладываются в тканях, например почек, кожи, легких. Высокое содержание циркулирующих иммунных комплексов (ЦИК) наблюдается при аутоиммунных, хронических воспалительных и инфекционных заболеваниях. С другой стороны, определение ЦИК в крови неспецифично, не отражает ни причину их нарастания, ни непосредственное влияние на органы.
Снижение уровней ЦИК на фоне лечения говорит о затихании воспалительного процесса и эффективности терапии.
Наиболее распространенными анализами на систему комплемента являются определение ключевых С3 и С4 компонентов. Показаниями для исследования – повторяющие инфекции, ревматические и аутоиммунные заболевания для выявления врожденных дефицитов комплемента, утяжеляющих течение этих болезней.
Исследуют уровни ЦИК, С3-компонент и С4-компонент комплемента.
Иммуноглобулины A, M, G, E
Общие иммуноглобулины – показатели гуморального иммунного ответа. Уровни IgM возрастают в острый период заболевания и при обострении хронической инфекции, IgG – в процессе выздоровления, IgA – в острый период заболевания, сохраняясь дольше IgM, отражают затяжное течение и поражение слизистых оболочек. Повышенные уровни IgE свидетельствуют об аллергическом воспалении.
Общие иммуноглобулины не объясняют причину инфекции, поэтому целесообразно смотреть специфические антитела к конкретным возбудителям. Основные показания для определения общих антител – это подозрение на врожденный иммунодефицит, связанный с гуморальным иммунитетом.
Интерфероновый статус и Интерлейкины
Исследования Интерфероновый статус, Интерлейкин-1бета, Интерлейкин-6, Интерлейкин-8, Интерлейкин-10, Фактор некроза опухоли-альфа и другие определяют уровни цитокинов – специфических маркеров иммунного ответа. Помогают в определении стадии заболевания, врожденных дефектов, онкологических заболеваний, активности воспалительного процесса и осложнений. Как правило, требуют динамического контроля для помощи в оценке клинической ситуации и эффективности лечения.
Фагоцитарная активность
Фагоцитарной активностью обладают нейтрофилы, моноциты-макрофаги и другие клетки. Фагоцитоз – это способность поглощать и переваривать антигены, вплоть до целых клеток. Он определяет возможности врожденного иммунитета и необходим для формирования приобретенного иммунитета. Оценка фагоцитарной активности клеток крови трудоемка и сложна. Используют такие тесты как оценка фагоцитоза бактерий с флюоресцентной меткой, тест по восстановлению нитросинего тетразолия.
Фагоцитарная активность повышается при бактериальных, аутоиммунных, аллергических заболеваниях.
Ее снижение наблюдается при врожденных дефектах фагоцитарной системы, хронических инфекциях.
Иммунограмма – это общее название всех исследований иммунного статуса. И в разных лабораториях включают разное сочетание анализов в зависимости от цели обследования. Для оценки клеточного иммунитета применяют исследование иммунофенотипов лимфоцитов. Для оценки гуморального иммунитета – общие иммуноглобулины, при необходимости дополняя их ЦИК, комплементом и белками острой фазы. Для оценки врожденного иммунитета больше подходят определения цитокинов в крови, фагоцитарная активность.
Лимфосумма клеточный иммунитет что означает
здоровым людям (взрослым и детям) для оценки индивидуальных показателей иммунограммы в стабильном, здоровом состоянии. Это необходимо знать для оценки иммунного статуса пациента при заболевании в сравнении с его границами нормальных показателей. Для каждого пациента более информативна именно индивидуальная норма, нежели показатели границ нормальных колебаний из стандартного бланка анализа. В этом аспекте как раз и повышается значимость наблюдений за изменениями иммунологических показателей в динамике.
пациентам (взрослым и детям), страдающим тем или иным заболеванием (как в стадии обострения, так и при хроническом течении), для возможности сделать вывод о наличии изменений в иммунном статусе, вызванных заболеванием. При обнаружении существенных отклонений иммунного статуса от нормы в двух и более показателях, даже при отсутствии симптомов болезни, пациент относится к группе повышенного риска развития иммунопатологии.
женщинам с привычным невынашиванием беременности, при бесплодии, в том числе неясного генеза, при многократных имплантационных потерях, как однократное самопроизвольное прерывание беременности, так и привычная потеря плода в естественном цикле и после применения ВРТ (ЭКО). Это позволяет выявить особенности иммунного статуса у женщин с такими проблемами и подобрать терапию при подготовке к беременности.
женщинам и мужчинам с рецидивирующими смешанными инфекциями урогенитального тракта для исключения нарушений в системном иммунитете и развитии вторичных иммунодефицитных состояний, которые часто становятся причиной хронизации инфекционных процессов и развития резистентности к общепринятой терапии
Основные показания к назначению анализа:
рецидивирующие инфекции, инфекционные заболевания с хроническим и затяжным течением (в том числе ВИЧ, гепатиты В и С, герпес, ВПЧ);
частые простудные заболевания (бронхиты, синуситы, отиты);
хронические тонзиллиты, гаймориты;
аллергические заболевания (крапивница, бронхиальная астма, атопический дерматит, поллиноз и др.);
подозрение на генетически обусловленный (первичный иммунодефицит, ПИД) или приобретённый иммунодефицит (вторичный иммунодефицит, ВИД);
подозрение на синдром приобретённого иммунодефицита (СПИД);
обследование реципиентов до и после трансплантации органов;
обследование пациентов перед серьёзными оперативными вмешательствами; осложнённое течение послеоперационного периода;
Возможные причины повышения и снижения показателя
Повышенное количество свидетельствует о гиперактивности иммунитета, наблюдается при T-клеточных лейкозах. Увеличение относительного показателя встречается при некоторых вирусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний. Может повышаться при приёме биологически активных добавок, длительном приёме лекарственных препаратов (особенно монотерапии), интенсивном занятии спортом и при беременности.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета. Выявляется при воспалениях разнообразной этиологии; вирусных, грибковых и паразитарных хронических инфекциях; аутоиммунных заболеваниях; доброкачественных и злокачественных новообразованиях; после травмы, операций, инфаркта, кровоизлияний, ожогов, стрессов; при курении, алкогольном циррозе печени, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является однозначным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Повышение выявляется при острой фазе аллергии, при ряде Т-клеточных лимфом, практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции.
Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях, иммуносупрессивной терапии.
Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных (особенно цитомегаловирусной инфекции и хроническом вирусном гепатите) и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, остром и хроническом стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях, сепсисе, гемофилии, малярии, шистосомозе, инфекционном мононуклеозе, кори, язвенном колите, перитоните, иммунодефиците с тимомой. Является однозначным признаком для ВИЧ-инфекции (менее 0,7).
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
Снижение наблюдается при физиологических и врожденных гипогаммаглобулинемиях и агаммаглобулинемиях, лечении иммунодепрессантами, острой вирусной и хронической бактериальной инфекциях, состоянии после удаления селезенки.
NK-клетки способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных и вирусных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, хроническом стрессе, дефиците цинка.
Т-лимфоциты, экспрессирующие маркеры NK-клеток
Эти клетки имеют свойства как Т-, так и NK-клеток. Исследование рекомендовано как дополнительный маркер при острых и хронических заболеваниях.
Т-клетки активированные (CD3+HLA-DR+D45+)
Маркер поздней и длительной активации клеток, показатель гиперреактивности иммунитета. По экспрессии данного маркера можно судить о выраженности и силе иммунного ответа. Появляется на Т-лимфоцитах после 3-го дня острого заболевания. При благоприятном течении заболевания снижается до нормы. Увеличение экспрессии на Т-лимфоцитах может быть при многих заболеваниях, связанных с хроническим воспалением. Отмечено его повышение у пациентов с гепатитом С, пневмониями, ВИЧ-инфекцией, солидными опухолями, аутоиммунными заболеваниями.
В норме клетки с подобным фенотипом в кровотоке присутствуют в незначительном количестве. Они представляют собой высокодифференцированные клетки памяти
Диагностика Т-клеточного иммунитета: пандемия как драйвер инновации
Диагностика Т-клеточного иммунитета: пандемия как драйвер инновации
Т-клеточный стартап TScan Therapeutics начал коллаборацию с компанией Qiagen для разработки теста на Т-клеточный иммунитет к COVID-19
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Споры о вакцинах и иммунитете против нового коронавируса кажутся бесконечными! От обсуждения ПЦР-диагностики и тестов на антитела дискуссии постепенно смещаются в сторону стойкости иммунитета: но измерить иммунитет человека по-прежнему сложно. Узнаем о том, как пандемия вдохнула новую жизнь в старую технологию и станет ли диагностика клеточного иммунитета доступной, в статье специалиста по Т-клеткам Софьи Касацкой.
Конкурс «Био/Мол/Текст»-2020/2021

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Вакцинация от коронавирусной инфекции SARS-CoV-2 — одна из самых горячих тем на границе 2020 и 2021 гг. Не утихают споры о безопасности вакцин, разработанных в сжатые сроки, о принципах производства и об основных принципах иммуногенности. Много спорят и о том, стоит ли добровольно прививаться тем, кто уже успел переболеть COVID-19, или, по крайней мере, подозревает об этом. Достаточно ли привиться один раз, а если вирус будет мутировать, как действовать дальше? Достаточно ли переболеть один раз или стоит бояться заболеть одной и той же инфекцией раз в сезон?
Для того чтобы ответить на эти вопросы и понять историю прошлых болезней, нужно изучить иммунную память (также ее называют иммунологической). Как правило, для проверки иммунной памяти на конкретную инфекцию проверяют наличие антител в плазме крови: ИФА-тест на антитела класса IgG (ИФА — иммуноферментный анализ). В этом тесте подсчитывается количество антител, которые сорбируются (прилипают) к стандартизированным антигенам, то есть молекулам, встречающимся именно у возбудителя данной инфекции и нигде больше. Антитела, в особенности класса IgG, поразительно точно и выборочно контактируют с однажды «выбранной» молекулой: мало где в биологии можно найти более точные и постоянные молекулярные контакты. Тем не менее тест на антитела — по большей части дань историческому процессу, а не «золотой стандарт» тестирования иммунной памяти. Пандемия стремительно изменила многие аспекты нашей жизни — может ли она поменять и то, что мы считаем стандартом в диагностике иммунитета?
Увидеть адаптивный иммунитет
«Биомолекула» неоднократно писала об уникальных механизмах, которые обеспечивают работу этой удивительной регуляторной системы — системы адаптивного иммунитета человека [1–3].
Чтобы увидеть Т-клетки и В-клетки разных типов, иммунологи чаще всего используют проточную цитометрию (FACS) [4]. Например, если мы хотим увидеть клетки памяти, то крепим флуоресцентную метку на молекулу, присутствующую только на поверхности клеток иммунной памяти, и подсчитываем клетки, пролетающие по одной через лазер и детектор флуоресценции.
Так можно узнать процент клеток, выполняющих определенную функцию, например, весь объем клеток памяти в крови на все прошлые инфекции. Теперь усложним задачу и выделим только клетки памяти на конкретную инфекцию — например, интересующий всех SARS-CoV-2, — как это сделать? Мы можем увидеть недавно активированные клетки среди клеток памяти. Лимфоциты из образца крови пациента смешиваются и инкубируются с молекулами, принадлежащими вирусу, чаще всего, — с очищенными белками, нарезанными на фрагменты. Т- и В-клетки, способные узнать и связать вирусный антиген, активируются, станут активированными эффекторными клетками, и мы сможем их различить среди всей иммунной памяти на FACS-анализе. Такие тесты проводятся в качестве дополнительных научных исследований.
Тест требует не только несколько часов на выделение клеток и их активацию вирусными белками либо пептидами, но и время дорогостоящего специалиста по проточной цитометрии, у которого прибор для FACS всегда работает и настроен, а не простаивает. Сочетание сразу двух факторов приводит к тому, что метод далеко не массовый. Можно представить метод рутинным в нескольких ведущих медицинских центрах, но сложно распространить: на порядки сложнее, чем внедрить регулярное ПЦР-тестирование.
Антитела или Т-лимфоциты
В качестве гораздо более дешевого и доступного теста, чем FACS, иммунологи смотрят не на сами клетки, а на то, что иммунные клетки производят [5]. Вспомним рецепторы, которые служат для решения задачи точного, прочного и выборочного связывания вирусных белков-антигенов. Т-клетки держат рецепторы на поверхности, на клеточной мембране. А вот В-лимфоциты свои уникальные рецепторы синтезируют как в мембранной, так и в растворимой форме — эти растворимые В-клеточные рецепторы и есть антитела. Получается, что вместо флуоресцентных меток и В-клеток памяти можно просто измерить концентрацию антител? Вдобавок, учебник иммунологии рассказывает, что В-клетки формируют память с помощью Т-клеток. Значит ли это, что если антитела есть, то уже произошло формирование памяти: сначала на уровне Т-клеток, затем на уровне В-клеток?
Да, текущие представления об иммунологии человека говорят: высокий уровень антител подразумевает, что Т-клеточный иммунный ответ тоже есть. Тем не менее известны и неклассические механизмы, при которых В-клетки быстро начинают производить антитела (чаще классов IgD, IgM) вне особых зон лимфоузла и при меньшем контроле со стороны Т-клеток. Обратная логика оказывается неверной: Т-клеточная иммунная память не зависит от наличия антител в крови, формируется независимо и сохраняется дольше.
Интуитивно кажется, что было бы отлично сохранять в крови антитела к коронавирусу после вакцинации или инфекции на всю жизнь. Некоторые инфекции формируют такой иммунный ответ, и это коррелирует с иммунной защитой, то есть вероятностью не заболеть при повторном заражении [6]. Но для других инфекций уровень антител в крови достаточно быстро, за несколько месяцев, снижается. Так происходит потому, что за свою жизнь человек встречает сотни тысяч типов вирусов, и производить антитела на все вирусные антигены просто невозможно. Приходится выбирать, происходит конкуренция с защитой от других инфекций, а также конкуренция с антителами, которые нужны для регуляции собственной физиологии организма. Антитела постепенно снижают концентрацию и пропадают из крови, но сохраняются В-клетки памяти, которые смогут вновь производить нужные антитела при необходимости.
Было бы идеально, чтобы организм производил антитела и держал их в оптимальной концентрации в крови не во время повторной болезни, а чуть заранее: до заражения. Именно для этого существуют сезонные ревакцинации: небольшая бустерная доза антигена поступает заранее и через 9–14 дней иммунитет снова подготовлен к сезонному контакту с большим количеством вирусных частиц вокруг. А постоянное, круглогодичное производство антител на высоком уровне можно оставить тем В-лимфоцитам, которые действительно каждый день сталкиваются с одними и теми же бактериями и вирусами: например, В-лимфоцитам слизистой ЖКТ, работающим с кишечными симбионтами.
ELISPOT: ИФА для Т-клеток?
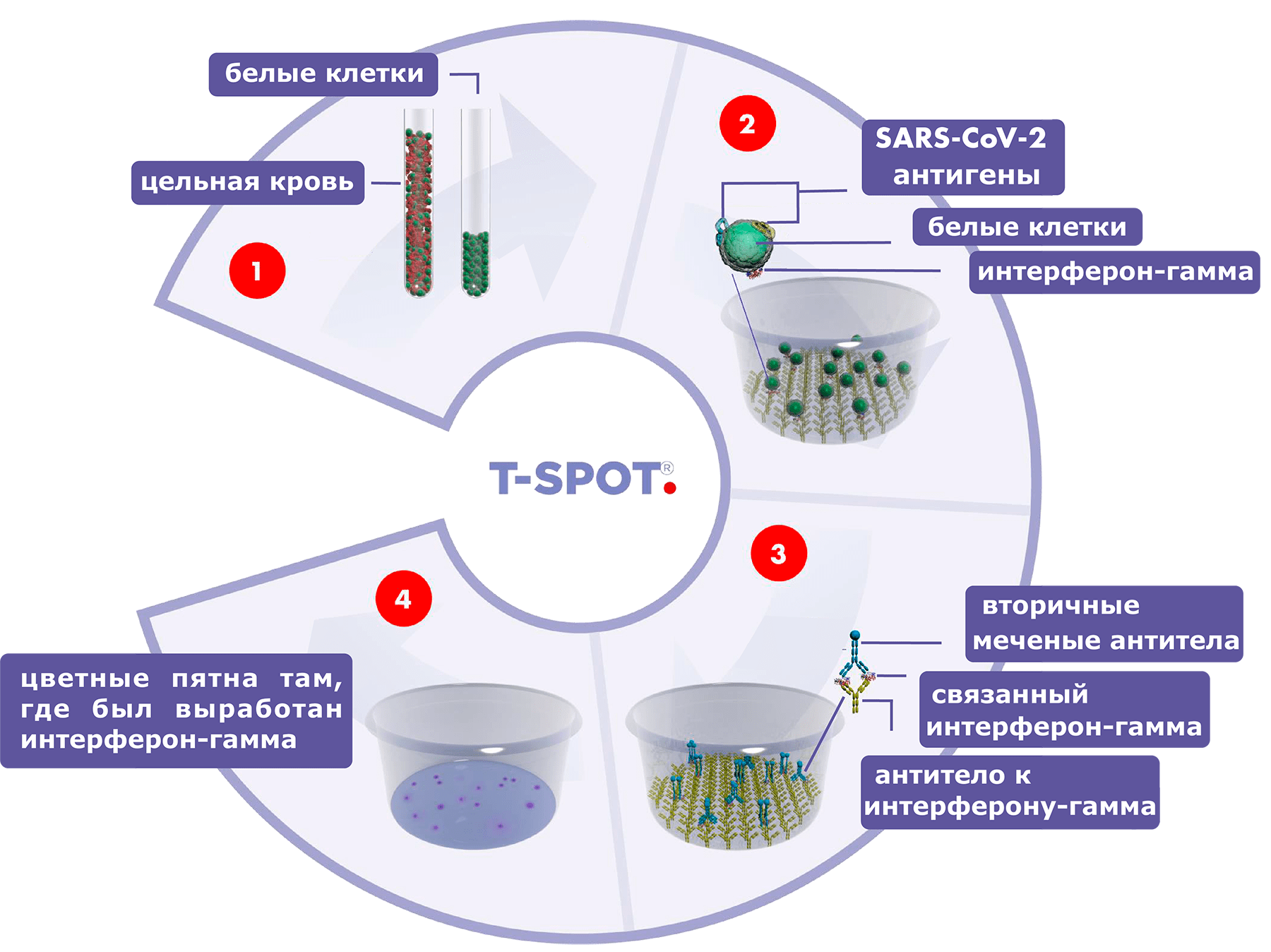
Антитела оказались удобным для измерения косвенным маркером иммунной памяти, но отсутствие антител еще не говорит об отсутствии Т-клеточной памяти. Специфичную иммунную память Т-клеток, к сожалению, нельзя измерить так же легко, по нескольким миллилитрам плазмы крови. Как упоминалось выше, Т-клетки не секретируют свои рецепторы в растворимом виде. Зато Т-лимфоциты, в соответствии со своей ролью дирижеров всего иммунного ответа, вырабатывают множество сигнальных молекул — цитокинов. Цитокины, в большинстве своем, — тоже растворимые молекулы, и их концентрацию можно измерить в объеме (суммарно), либо «подсветить» с помощью флуоресцентных меток сразу при их секреции из специфичных Т-клеток (и увидеть соответствие клетка—сигнал). На этом принципе основан иммуноферментный анализ на клональных отпечатках Т-клеток, или ELISPOT (enzyme-linked immunosorbent spot).
Как правило, Т-хелперы секретируют сигнальные цитокины, чья основная задача — активировать нужную ветвь иммунного ответа, привлечь клетки врожденного иммунитета и подавить конкурирующие сигналы. Среди функций цитокинов — подача сигналов внутри иммунной системы — от Т-клеток и для Т-клеток для уточнения принятия решений. Подобная информация «для внутреннего использования» передается и от Т-хелперов Т-киллерам, и в обратном направлении. Яркий пример такого сигнала — интерферон-гамма: активированные Т-киллеры секретируют IFNγ наравне с Т-хелперами. Массовая выработка интерферона позволяет быстро распространить информацию на уровне всего организма. На основе измерения продукции IFNγ Т-клетками разработан самый надежный из ELISPOT-тестов на антиген-специфичный Т-клеточный ответ [7], [8].
Для ELISPOT живые изолированные Т-клетки периферической крови инкубируются с антигенами, как правило, белковыми либо пептидными. Этот процесс должен имитировать то, как в организме Т-клетки в лимфоузлах узнают антигены и активируются: процесс презентации антигена. Небольшая доля специфичных клеток узнает антигены и производит IFNγ, причем интерферон сразу фиксируется и позже визуализируется в точке секреции. В процессе активации Т-клетки делятся: из одной клетки образуется целый клон антигенспецифичных клеток, все они производят интерферон, и при визуализации «пятно» продукции интерферона растет в диаметре (рис. 1). При ELISPOT сложно точно сказать, сколько антигенспецифичных клонов было изначально в образце до активации, размножения и формирования пятна. Остается неясным, сколько Т-клеток узнают антиген in vivo, но не прореагировали из-за искусственной формы презентации антигена, не похожей на то, как Т-клетки обычно активируются в лимфоузлах. С другой стороны, метод немного проще оптимизировать в лаборатории и проще делать для многих пациентов одновременно, чем более дорогостоящий FACS-анализ; требующиеся приборы и реагенты дешевле.
Рисунок 1. Схема работы теста ELISPOT, определяющего активацию Т-лимфоцитов при взаимодействии с антигенами нового коронавируса SARS-CoV-2
[11], рисунок с изменениями
Поиск коронавирусных Т-клеток. Инновация TScan
ELISPOT используется во всех лабораториях, которые исследуют иммунитет человека. Метод ELISPOT и его модификации на пересекающихся пулах пептидов (наборах фрагментов, на которые нарезается белковый антиген) использовались в исследованиях эффективности вакцин от ВИЧ, и позже медленно распространились на исследования и других вакцин. В диагностических лабораториях метод стал популярен потому, что для более точной диагностики туберкулеза необходимо оценивать Т-клеточный иммунный ответ. Коммерческий тест получил название T-SPOT. Кроме туберкулеза, для других инфекций аналогичная диагностика не применялась — до 2020 года и кризиса, вызванного новой коронавирусной инфекцией SARS-CoV-2. Необходимость широкой диагностики самой инфекции и иммунной памяти к ней подтолкнула одновременно исследователей и производителей диагностических тестов к разработке новых методов и оптимизации старых и привычных. Интерес к быстрому и дешевому измерению Т-клеточной памяти растет параллельно с популярными в медиа опасениями, что у переболевших COVID-19 быстро пропадают антитела в крови.
Очень многие академические коллективы, которые работают на стыке биохимии, иммунологии человека и прикладных биотехнологий, весной 2020 года стали заниматься разработками для борьбы с пандемией, в том числе разрабатывать и налаживать диагностику инфекции. Нельзя не упомянуть пример коллектива Григория Ефимова из НМИЦ гематологии в Москве, активно работающий как над диагностикой Т-клеточного иммунитета к новому коронавирусу на основе FACS, так и в коллаборации по созданию одного из ИФА-тестов для определения антител к антигенам SARS-CoV-2 [9], [10]. Тем не менее вернемся к теме масштабируемого производства быстрых ELISPOT-тестов на Т-клеточный иммунитет: откуда берутся такие разработки, тоже из фундаментальных и клинических академических лабораторий?
Первой ELISPOT-тест на ковид (T-SPOT Discovery SARS-CoV-2 assay) выпустила компания Oxford Immunotec, ранее создавшая одну из самых популярных версий теста на туберкулез [11]. Этот тест использует пул разнообразных антигенов коронавируса и активацию Т-клеток в смеси с другими лейкоцитами периферической крови: иначе говоря, дизайн теста даже несколько упрощен по сравнению с тестом на туберкулез (рис. 1).
Куда более интересную модификацию запустил небольшой биотех-стартап под названием TScan Therapeutics. Этот стартап переориентировался на инфекционную иммунологию во время пандемии. Как и многие другие коллективы, к примеру, BioNTech (разработчик вакцины от коронавируса совместно с Pfizer), до пандемии они занимались онкологией и задачей оптимальной активации противоопухолевого иммунитета.
Осенью 2020 года TScan Therapeutics подписали соглашение о совместной разработке диагностического теста ELISPOT-типа с компанией Qiagen — крупнейшим производителем лабораторных реагентов и универсальных наборов для типовых экспериментов в молекулярной и клеточной биологии [12], [13]. Эта диагностика Т-клеточной памяти во многом отличается от версии Oxford Immunotec, и в первую очередь отличается идеологически: оксфордская компания быстро и практично сделала аналог своего существующего продукта-бестселлера, сохранив всю платформу и протокол метода и изменив только антиген. TScan же демонстрирует почти идеальный инновационный подход: вначале провели исследования Т-клеточного иммунитета, опубликовали выводы в престижном журнале Immunity, затем появилась идея для диагностического теста и, наконец, возможность производства в партнерстве с Qiagen.
Исследование TScan раскрывает детали того, какие молекулы среди белков коронавируса вызывают наибольший «интерес» у Т-клеток человека [14]. Иммунная память Т-киллеров, согласно исследованию, формируется не только и не столько на фрагменты антигена (эпитопы) S-белка коронавируса, на котором сфокусировано большинство вакцин 2020 года [15]. Напротив, эпитопов гораздо больше в нуклеокапсидном основном белке [16]. Далее, специалисты TScan показали отсутствие перекрестного иммунитета: антигены «сезонных» неопасных человеческих коронавирусов формируют память Т-киллеров, но эти Т-киллеры не способны отреагировать на коронавирус SARS-CoV-2. Наоборот, между SARS-CoV-1 (вызвавшим вспышку атипичной пневмонии в 2003 году) и SARS-CoV-2 существует значительная кросс-реактивность Т-клеток (переболевшие атипичной пневмонией могут быть защищены от SARS-CoV-2).
Обнаружение важнейших участков вируса, вызывающих долгую Т-клеточную память — это поиск иммунодоминантных эпитопов. Если активировать Т-клетки именно такими пептидами, можно существенно повысить качество диагностического теста. Уникальные данные TScan позволяют вычесть фон иммунной памяти на родственные и далекие коронавирусы и поднять специфичность диагностики иммунной памяти. При этом используется платформа, сходная с ELISPOT, что позволяет объединять много образцов и делать тест быстрым и широко доступным. Сейчас исследования Т-клеточного иммунитета при коронавирусе проводится либо в рамках научных исследований, либо на коммерческой основе, но точность и интерпретация теста затруднена, клиент получает результат через 1–2 неделю после теста. Партнерство TScan с Qiagen вселяет оптимизм по поводу доступности теста: ведь продукцией этой компанией пользуются буквально в каждой молекулярной и биохимической лаборатории на планете.
Интересна еще одна деталь. Исследователи из TScan брали донорские Т-клетки у доноров с наиболее распространенными в США генотипами других важных иммунных молекул: молекул HLA (молекул главного комплекса гистосовместимости, Human Leukocyte Antigen) подтипов HLA-A*02:01, HLA-A*01:01, HLA-A*03:01, HLA-A*11:01, HLA-A*24:02 и HLA-B*07:02. В зависимости от типа молекул HLA Т-клетки будут распознавать разные эпитопы одного и того же вируса. А поскольку у разных людей максимально вариабельные молекулы HLA, то и иммунный ответ Т-клеток у каждого формируется максимально индивидуально. Именно с этим связаны и сложности/дороговизна изучения Т-клеточного иммунитета, и невозможность «перелить иммунную память» переливанием крови — такой эксперимент может получиться только внутри пары однояйцевых близнецов. С другой стороны, даже в этом огромном разнообразии реакций клеточного иммунитета Т-клетки разных доноров, отвечающие на новый коронавирус, обладают некоторыми общими характеристиками.
Данные об общих параметрах иммунного ответа, которые будут накапливаться в совместных исследованиях TScan/Qiagen, представляют несомненный интерес для оптимизации лечения пациентов и создания методов лечения, таргетно направленного на активный и безопасный Т-клеточный ответ. Здесь проявляется особая черта сильных deeptech-стартапов в области биологии, биоинформатики и биотехнологий: технологическая платформа может быть использована не только для одного применения и быстрого завоевания рынка, а для разных задач, и в процессе, по ходу решения прикладной задачи возникают ценные, качественные и заметные научные открытия. Конечно, новость о сотрудничестве TScan и Qiagen — всего лишь одна из множества историй о биотех-прорывах 2020 года, и легко могла затеряться среди других новостей и инноваций. Но в этой неприметной новости заложен мощный потенциал, способный изменить современные представления о клинической диагностике иммунной памяти.