Медикаментозный сон для чего вводят
Медикаментозная седация
Для того, чтобы лучше разобраться, что же такое медикаментозный сон, надо понять, какие основные уровни сознания выделяет врач для оценки состояния сознания человека.
При проведении наркоза врач анестезиолог-реаниматолог благодаря сочетанию разных групп препараторов создает условия, при которых сознание у пациента снижается до комы, проходя все стадии, иногда настолько быстро, что оценить промежуточные состояния невозможно.
При всех высокотравматичных операциях проводят комбинированные эндотрахеальные наркозы — это позволяет сохранить человеку жизнь и защитить головной и спинной мозг от травмирующей информации, приходящей от места операции.
При слове наркоз у большинства людей возникает страх за жизнь, но нужно понимать:
Медикаментозная седация — состояние сопора, вызванное лекарственным препаратом.
Деление препаратов условно, для лучшего понимания врачом, что он назначает и какой эффект будет получен в зависимости от дозы, кратности, скорости введения. Препаратов, которые будут проявлять только один эффект на человека, даже при увеличении дозы, практически не существует, поэтому задача специалиста — точно оценить исходное состояние, чтобы правильно подобрать дозировку. Из-за уникальности каждого человека терапевтическая широта препарата (условное понятие для оценки минимальной и максимальной дозы в миллиграммах препарата на килограмм массы тела в минуту введения) для каждого человека своя.
Но наркоз — дело серьёзное. Как врач анестезиолог-реаниматолог могу порекомендовать Вам:
Желанию Вам здоровья, долгих лет жизни и профессиональных специалистов по жизни.
Внутривенная медикаментозная седация
Процедура представляет собой процесс погружения в медикаментозный сон в расслабленном состоянии.
Для чего проводится
Прямыми показаниями к внутривенной медикаментозной седации являются:
Безопасность процедуры
Опытный врач нашей клиники не допускает передозировки, вводя вещество небольшими порциями.
В процессе лечения анестезиолог наблюдает за состоянием пациента (уровнем кислорода в крови, частотой сокращений сердца, артериальным давлением) через кардиомонитор. По необходимости восполняется дефицит жидкости, регулируется свертываемость кровотока нестероидными медикаментами. У реаниматолога всегда под рукой имеется препарат, который является антидотом к седации.
Безопасность внутривенной седации подтверждается отсутствием угнетения системы дыхания, рвотных позывов.
Как проводится
Препарат вводится в вену на локтевом сгибе шприцевым дозатором. При этом никакой болезненности и дискомфорта не возникает. Врач разговаривает с пациентом, оценивает состояние по ответам, связанности речи. Постепенно больной погружается в сон, который схож с физиологическим.
В некоторых случаях, когда вены невыраженные, сначала пациент погружается в сон через маску. Только после наркоза вводится седационные вещества.
Период восстановления
Пациент выходит из медикаментозного сна в присутствии анестезиолога и медицинских работников. Врач восстанавливает механизм ауторегуляции.
В отличие от общего наркоза, оперируемый мягко выходит из состояния медикаментозного сна. После того, как человек пришел в себя, рекомендуется соблюдать покой. Нужно ограничить двигательную активность, действия, которые требуют повышенное внимание.
Общее время реабилитация около двух часов. Перед тем как выписать больного домой, врач перечисляет небольшой список ограничений:
Опыт специалистов Клиники Здоровья
Проводя процедуру, можно быть уверенным в профессионализме врача. В клинике работает анестезиолог с опытом работы более 20 лет. Специалист применяет все свои знания, подбирает нужный вид обезболивающего средства, отталкиваясь от состояния каждого пациента.
Медикаментозный сон для чего вводят
Угнетение дыхания, гипотензия
Отрицательные побочные эффекты седативных препаратов в ОАРИТ:
— развитие толерантности к препаратам;
— избыточный седативный эффект;
— нарушение перистальтики желудочно-кишечного тракта;
— появление симптомов отмены;
Дексмедетомидин. Является селективным агонистом α2-адренорецепторов, но не обладает селективностью к A, B и C подтипов α2-адренорецепторов. Препарат обладает седативным, обезболивающим и симпатолитическим эффектами, но без противосудорожного действия, позволяет снизить потребность в опиоидах. Седация при назначении дексмедетомидина имеет определенные особенности. Пациенты, получающие инфузию дексмедетомидина, легко просыпаются и способны к взаимодействию с персоналом, а признаки угнетения дыхания выражены минимально. α2-агонисты вызывают активацию α2A-адренорецепторов в голубом пятне (locus coereleus) и стволе мозга. Это, в свою очередь, приводит к ингибированию выброса норадреналина и гиперполяризации возбудимых нейронов, что вызывает седативный эффект [32]. Поэтому седация, вызванная применением дексмедетомидина, близка к естественному сну [33].
Дексмедетомидин легко проникает через гематоэнцефалический барьер и обладает анальгетическим эффектом, особенно в сочетании с низкими дозами опиоидов или местных анестетиков [33 — 35].
Таким образом, симпатолитический эффект дексмедетомидина связан с уменьшением высвобождения норадреналина из симпатических нервных окончаний [36], а седативный эффект опосредован снижением возбуждения в голубом пятне, основном центре норадренергической иннервации центральной нервной системы [37].
Дексмедетомидин не вызывает депрессии дыхания. Препарат может применяться для седации самостоятельно дышащих неинтубированных пациентов и пациентов, которым проводят неинвазивную масочную вентиляцию легких. После прекращения введения дексмедетомидин не оказывает каких-либо остаточных влияний на систему дыхания.
При использовании дексмедетомидина могут возникать гипотензия и брадикардия, но они проходят обычно самостоятельно, без дополнительного лечения. При седации дексмедетомидином возникает также побочный эффект в виде расслабления мышц ротоглотки [8].
Согласно инструкции по медицинскому применению лекарственного препарата, размещенной в Государственном реестре лекарственных средств Российской Федерации, дексмедетомидин показан для седации у взрослых пациентов, находящихся в отделении интенсивной терапии, необходимая глубина которой не превышает пробуждения в ответ на голосовую стимуляцию (соответствует диапазону от 0 до –3 баллов по шкале ажитации — седации Ричмонда, RASS).
Препарат противопоказан при:
— гиперчувствительности к компонентам препарата;
— атриовентрикулярной блокаде II—III степени (при отсутствии искусственного водителя ритма);
— неконтролируемой артериальной гипотензии;
— острой цереброваскулярной патологии;
Пациенты на ИВЛ могут быть переведены на инфузию дексмедетомидина с начальной скоростью 0,7 мкг/(кг×ч) с последующей постепенной коррекцией дозы в пределах 0,2—1,4 мкг/(кг×ч) с целью достижения необходимой глубины седации. Седация наступает в течение 5—10 мин, пик наблюдается через 1 ч после начала в/в инфузии дексмедетомидина, длительность действия препарата после окончания инфузии составляет 30 мин. После коррекции скорости введения препарата необходимая глубина седации может не достигаться в течение 1 ч. При этом не рекомендуется превышать максимальную дозу 1,4 мкг/(кг×ч).
Для ослабленных пациентов начальная скорость инфузии дексмедетомидина может быть снижена до минимальных значений. У пожилых пациентов не требуется коррекция дозы.
Если нужно ускорить начало действия препарата, например при выраженном возбуждении, рекомендовано проводить нагрузочную инфузию в дозе 0,5—1,0 мкг/кг массы тела в течение 20 мин, т.е. начальную инфузию 1,5—3 мкг/(кг×ч) в течение 20 мин. После нагрузочной дозы скорость введения препарата снижается до 0,4 мкг/(кг×ч), в дальнейшем скорость инфузии можно корригировать.
Пациенты, у которых адекватный седативный эффект не достигнут на максимальной дозе препарата, должны быть переведены на альтернативное седативное средство. Введение насыщающей дозы препарата не рекомендуется, так как при этом повышается частота побочных реакций. До наступления клинического эффекта дексмедетомидина допускается введение пропофола или мидазолама. Опыт применения дексмедетомидина в течение более 14 дней отсутствует, при применении препарата более 14 дней необходимо регулярно оценивать состояние пациента.
Дексмедетомидин имеет ряд преимуществ по сравнению с другими седативными средствами, так как обладает одновременно седативным и анальгетическим действием, практически не влияет на внешнее дыхание и не вызывает кумулятивного эффекта, способствует уменьшению времени пребывания в ОАРИТ и на ИВЛ [42, 43].
Успешное применение дексмедетомидина в условиях ОАРИТ в России [44—47] позволяет рекомендовать препарат в качестве одного из основных седативных средств для пациентов как на пролонгированной ИВЛ, так и на самостоятельном дыхании.
К агонистам α2-адренорецепторов относится также клонидин, который обладает влиянием на α1-адренорецепторы, оказывает анальгетическое и седативное действие, при этом имеет значительно более низкую стоимость. Существует ряд исследований, описывающих успешное применение клонидина в ОАРИТ, в том числе при длительной седации и отлучении от вентилятора [48—50]. Однако в российской инструкции к препарату клонидин в показаниях к применению седация отсутствует, в связи с чем клонидин не был включен в данные клинические рекомендации.
Пропофол. Коротко действующий гипнотик. Механизм действия достаточно сложен и обусловлен воздействием на различные рецепторы центральной нервной системы, в том числе рецепторы γ-аминомасляной кислоты, глицина, никотиновой кислоты и М1-мускариновые рецепторы. Препарат обладает седативным, снотворным, амнестическим, противорвотным и противосудорожным действием, но лишен обезболивающего эффекта [51]. Пропофол хорошо растворяется в липидах и проникает через гематоэнцефалический барьер, что обеспечивает быстрое наступление седативного эффекта. При этом печеночный и внепеченочный клиренс пропофола высок, что обусловливает быстрое прекращение действия препарата. В связи с этим применение пропофола может быть рекомендовано для пациентов, которым требуется частое пробуждение для неврологической оценки, или при дневном прерывании седации [52]. При длительном применении пропофола может произойти насыщение периферических тканей, что приведет к более длительному действию и более медленному выходу из седации [53]. Так же как и бензодиазепинов производные, пропофол вызывает угнетение дыхания и гипотензию, особенно у пациентов с уже имеющейся дыхательной недостаточностью или гемодинамической нестабильностью. Эти эффекты потенцируются одновременным назначением других седативных средств или опиоидов.
Доза введения пропофола в ОАРИТ составляет 0,3—4,0 мг/(кг×ч) и не должна превышать 4 мг/(кг×ч). Для пожилых пациентов скорость инфузии препарата должна быть снижена. Через 3 дня введения пропофола необходимо проверить уровень липидов крови. Длительность седации пропофолом не должна превышать 7 дней.
К побочным эффектам пропофола относятся гипертриглицеридемия, острый панкреатит и миоклонус [54—58]. Пропофол может также вызывать аллергические реакции у пациентов с аллергией на яичный лецитин и соевое масло (так как растворен в 10% эмульсии липидов, содержащей эти вещества). В 1% случаев возможно возникновение инфузионного синдрома пропофола. Степень тяжести синдрома может существенно различаться. Основными проявлениями являются метаболический ацидоз, гипертриглицеридемия, гипотензия, артимии. В более тяжелых случаях развивается острая почечная недостаточность, гиперкалиемия, рабдомиолиз и печеночная недостаточность [53, 55, 59, 60]. Причиной развития инфузионного синдрома является нарушение метаболизма жирных кислот и углеводов и накопление промежуточных продуктов метаболизма пропофола. Как правило, синдром инфузии пропофола возникает при использовании высоких доз препарата, но описан и при инфузии низких доз [61—63]. Распознавание синдрома инфузии имеет важное значение, так как летальность при его развитии остается высокой (до 33%) [64]. Лечение пациентов с синдромом инфузии пропофола в основном симптоматическое.
Бензодиазепинов производные. Механизм действия бензодиазепинов производных основан на взаимодействии с рецепторами γ-аминомасляной кислоты в головном мозге. Препараты обладают седативным, амнестическим, снотворным и противосудорожным эффектами, но не имеют обезболивающего действия. При этом мидазолам обладает более выраженным эффектом, чем диазепам. Отмечается повышенная чувствительность к бензодиазепинам у пожилых [65]. Бензодиазепины могут вызывать угнетение дыхания, а также артериальную гипотензию, особенно в сочетании с опиоидами [66]. При длительном применении развивается толерантность к препаратам данной фармакологической группы.
Все бензодиазепины метаболизируются в печени, поэтому их выведение замедлено у пациентов с печеночной недостаточностью, пожилых, а также при одновременном применении с препаратами, ингибирующими ферментную систему цитохрома P450 и конъюгацию глюкуронида в печени [67—69]. При почечной недостаточности могут накапливаться активные метаболиты мидазолама и диазепама [70].
При длительном применении бензодиазепинов возможно длительное восстановление сознания после окончания введения за счет насыщения периферических тканей, особенно при печеночной, почечной недостаточности и в пожилом возрасте. Особенно большой длительностью действия обладает диазепам [71]. При применении бензодиазепинов возможна повышенная частота развития делирия.
Паллиативная седация: регуляторные, этические и клинические аспекты
Статья авторов Д.В. Невзоровой и Т.А. Гремяковой, опубликованная в журнале «Pallium: паллиативная и хосписная помощь» (№1 (2), 2019). Текст публикуется с разрешения редакции журнала.
Аннотация
Паллиативная седация применима, когда неизлечимо больные пациенты в конце жизни страдают физически и невосприимчивы к усилению стандартных методов лечения. Адекватная практика ее применения не приводит к уменьшению продолжительности жизни. Паллиативная седация показана как исключение из правил после обсуждения с пациентом и его представителями и принятия решения мультидисциплинарной командой медиков. Что касается необходимой степени седации, сознание пациента следует снижать до уровня, требуемого для облегчения страданий. Этот принцип помогает определиться с моментом начала процедуры и титрованием дозы седативных средств. Бензодиазепины остаются основными препаратами паллиативной седации, дозы зависят от массы тела больного, состояния почек и печени, статуса гидратации, наличия сопутствующих симптомов.
Паллиативная седация – контролируемое введение седативных препаратов с целью уменьшения сознания пациента до уровня переносимости рефрактерных и невыносимых симптомов. Она применима в тех случаях, когда неизлечимо больные пациенты в конце жизни страдают от физических симптомов, невосприимчивых (рефрактерных, резистентных) к стандартным методам лечения. Цель паллиативной седации – избавление от боли и страданий, но не приближение смерти. Результаты клинических исследований показывают, что паллиативная седация применяется в основном у онкологических больных при делирии, одышке, болях, рвоте и тошноте. Адекватная практика ее применения не приводит к уменьшению продолжительности жизни. Паллиативная седация показана на терминальных стадиях заболеваний как исключение из правил после обсуждения данного вопроса с пациентом и его представителем и принятия решения мультидисциплинарной командой медиков. Что касается необходимой степени седации для данного пациента, сознание пациента следует снижать до уровня, который требуется для облегчения страданий от резистентных к лечению симптомов. Этот принцип помогает определиться с моментом начала процедуры и титрованием дозы седативных средств. Бензодиазепины, особенно мидазолам, остаются основными элементами процедуры паллиативной седации. Индивидуальные дозы седативных препаратов могут варьироваться, поскольку они зависят от массы тела больного, функционального состояния почек и печени, статуса гидратации и наличия сопутствующих симптомов. Можно и нужно продолжать лечение любыми другими препаратами, которые ранее использовались для купирования симптомов, однако с началом паллиативной седации следует прекратить повышать их дозу во избежание возникновения возможных побочных эффектов.
Терминология
Купирование мучительных симптомов неизлечимых болезней в конце жизни подчас становится для медиков трудновыполнимой задачей, несмотря на интенсивный паллиативный уход за больными. В случае невосприимчивости симптомов к стандартным лечебным мерам может быть показана паллиативная седация, цель которой избавление от боли и страданий, но ни в коем случае не приближение смерти [1].
Во избежание путаницы необходимо определиться с терминологией. В мировой практике существует несколько процедур, связанных с уходом больного пациента из жизни:
эвтаназия – введение пациенту летального препарата с целью избавления его от неизлечимых и невыносимых страданий;
ассистируемое врачом самоубийство – предоставление врачом пациенту необходимой информации/и/или препаратов, позволяющих больному совершить акт самоубийства;
паллиативная седация – контролируемое введение седативных препаратов с целью уменьшения сознания пациента до уровня переносимости рефрактерных и невыносимых симптомов (одобрено American Medical Association (AMA) в 2008 г.)
В данном обзоре речь пойдет только о паллиативной седации, но даже это определение не является однозначным, и смысл, который вкладывают в него клиницисты, существенным образом различается. Так, в литературе наряду с паллиативной седацией можно найти терминальную, общую, контролируемую, глубокую, непрерывную глубокую седацию (Сontinuous deep sedation (CDS)), седационную терапию и седацию умирающих пациентов. Многочисленность синонимов объясняет, почему только 40% опрошенных врачей соглашаются дать определение паллиативной седации без оговорок [6].
Анализ данных литературы выявил большой разброс в распространенности применения паллиативной седации среди неизлечимо больных пациентов – от 2 до 52%. От 10 до 50% пациентов в программах паллиативной помощи по-прежнему отмечают наличие значительной боли за неделю до смерти. Наиболее распространенные симптомы, наблюдаемые у этих пациентов, – одышка, боль, бред, рвота. Большинство симптомов физические по природе. В ретроспективном анализе 54% пациентов имели больше чем один неподконтрольный симптом [6].
Международный опыт
В США паллиативные отделения могут сообщить, что 23% из 186 пациентов после паллиативной седации выписаны из госпиталя [3].
В Европе нет единых стандартов проведения паллиативной седации:
Бельгия и Нидерланды – эвтаназия легализована, применение продолжительной глубокой седации считается нормой и очень похожа на эвтаназию, семья обычно прощается перед тем, как пациента переведут в бессознательное состояние. В той же Бельгии уровень применения CDS в одной из клиник за 6 лет сократился с 7 до 3% в результате оптимизации управления симптомами и использования командного подхода при принятии решения [3].
Великобритания следует директивам Европейской ассоциации паллиативной помощи (European Association for Palliative Care), которая подчеркивает необходимость титрования дозы пропорционально симптомам, сохраняя, по возможности, сознание пациента [3].
Франция в 2016 г. приняла закон, разрешающий терминальную седацию для неизлечимо больных пациентов [1].
Швейцария – доля терминальной седации в смертности паллиативных больных в Цюрихе, по данным 2013 г., составила 17,5%. Для сравнения в 2001 г. этот показатель равнялся всего 4,7%. Эксперты всерьез обеспокоены таким существенным ростом, так как в стране запрещена эвтаназия подобного рода. Одной из причин роста случаев искусственного сна эксперты называют чрезмерное искусственное продление жизни бессмысленной терапией [1].
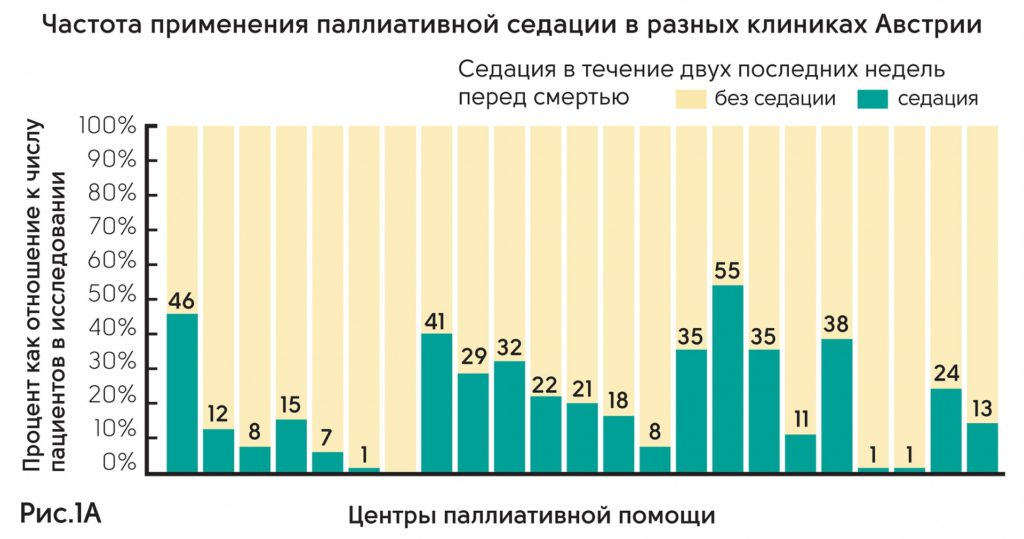
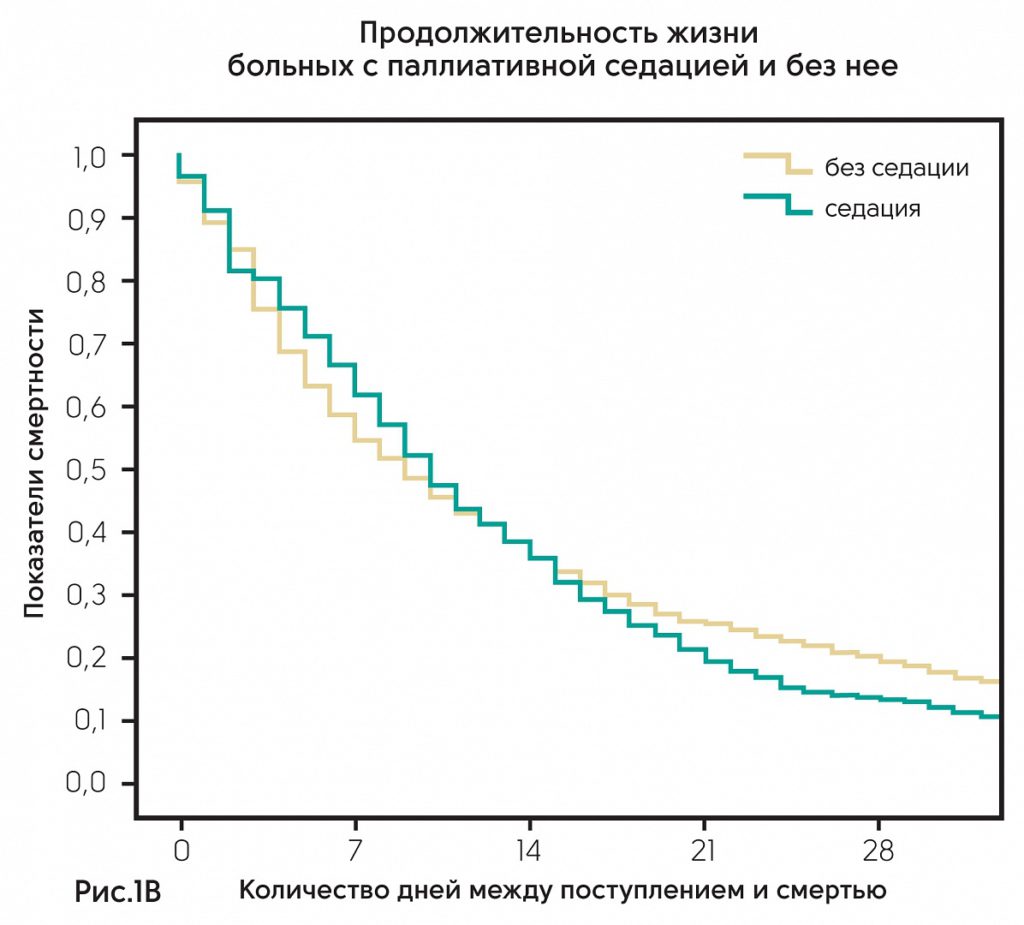
Австрия – проанализированы клинические данные по 2414 пациентам в 23 из 31 отделения паллиативной помощи Австрии. Результаты показали, что частота применения паллиативной седации в разных клиниках колеблется от 0 до 55% (рис. 1А). Из 2414 только 502 получали седацию. Из них 356 (71%) получали непрерывную седацию до момента смерти, 119 (24%) – прерывистую седацию. Среднее время седации составляло 48 ч (IQR 10–72h); 168 пациентов (34%) получали седативные препараты менее 24 ч. Показания для седации – делирий (51%), экзистенциальный дистресс (32%), нарушение дыхания (30%), боль (20%). Основное заболевание – онкология (92%). Среднее количество дней жизни между госпитализацией и смертью у пациентов с седацией статистически не различалось и составляло 10 против 9 дней (p = 0,491) (рис. 1В).
Япония – рассчитанное применение продолжительной глубокой седации у больных с экзистенциальным дистрессом – 1% (90 случаев/8,661 общего числа смертей пациентов). Прогнозируемое время жизни в 94% случаев составляло не более 3 недель. Показания для продолжительной глубокой седации – ощущение бессмысленности/бесполезности (61%), нагрузка на других/зависимость/неспособность к самообслуживанию (48%), боязнь смерти/тревожность/страх/паника (33%), желание самостоятельно контролировать время смерти (24%), изоляция/отсутствие социальной поддержки (22%) [7].
Отсутствие единообразия в терминологии сказывается на представляемых результатах клинических исследований, где под паллиативной седацией имеется в виду и рутинная седация, и другие практики, не имеющие отношения к паллиативной седации [3].
Предлагаются другие дефиниции для замены неоднозначно трактуемой медикаментозной процедуры паллиативной седации. Так, Твайкросс в 2017 г. [3] предложил ввести термин непрерывной глубокой седации (Сontinuous deep sedation – CDS) как основную цель терминального лечения, применяемую только в исключительных случаях.
Но пока это не рассмотрено на законодательном уровне, следует руководствоваться установленными нормами и определениями паллиативной седации, принятой многими международными организациями, действующими в области паллиативной медицины:
Данные организации единогласны в том, что паллиативная седация показана в случае невыносимых физических страданий пациентов в конце их жизни, но не может применяться при экзистенциальном дистрессе, требующем других способов коррекции [6, 9, 10, 11, 12].
Показания для использования паллиативной седации
Паллиативная седация применяется в тех случаях, когда неизлечимо больные пациенты в конце жизни страдают от неконтролируемых симптомов, невосприимчивых (рефрактерных, резистентных) к стандартным методам лечения. В обзоре литературы о применении паллиативной седации у пациентов с неизлечимыми онкологическими заболеваниями за 2012 год по результатам 30‑летних клинических исследований паллиативная седация применялась при делирии у 54% из 774 пациентов, при одышке – у 30%, при болях – у 17% и при тошноте – у 5% [4].
Атрибуты рефрактерных симптомов [5]:
Когда следует принимать решение о паллиативной седации? В наличии должны быть следующие факторы [6]:
Отказ от реанимации в данном случае не противоречит законодательству РФ. Согласно статье 66 ФЗ № 323 РФ, «в некоторых случаях реанимационные мероприятия не проводятся (пункт 7) – «на фоне достоверно установленных неизлечимых заболеваний».
Перед началом паллиативной седации стандартной процедурой является получение информированного согласия пациента и прикрепление этого документа к медицинской карте. Необходимо в любой ситуации уважать автономность пациента, а если он не может или не хочет участвовать в принятии решения, то следует организовать процесс принятия решения вместо пациента его родственником или назначенным законным представителем. Лучше всего, если информированное согласие будет получено у пациента до того, как возникнет необходимость начать паллиативную седацию, предпочтительно в присутствии члена его семьи или его назначенного представителя и с разрешения пациента. В таком случае пожелания пациента будут должным образом учтены, даже если в момент, когда показана паллиативная седация, у пациента уже отсутствует ясная речь.
В процессе получения согласия на встрече с членами семьи необходимо разъяснить основные моменты, в том числе рассказать о текущем состоянии пациента, прогнозе, этиологии резистентных симптомов. Кроме того, необходимо объяснить, почему есть основания полагать, что адекватное купирование симптомов невозможно обеспечить стандартными методами лечения, представить риски и преимущества паллиативной седации и подробно описать процесс седации с заранее установленными целями этого процесса.
Ведение паллиативной седации
Паллиативной седации можно достичь различными методами. Чтобы понять, какой из них будет наиболее эффективным, лечащему врачу, возможно, придется принять во внимание несколько факторов, таких как характер, начало проявления и тяжесть симптомов пациента, общий прогноз, а также цели и желания пациента/семьи.
Что касается необходимой степени седации для данного пациента, сознание пациента, согласно принципу пропорциональности, нужно снижать до уровня, который требуется для облегчения страданий от резистентных симптомов. Этот принцип помогает определиться также с моментом начала процедуры и титрованием дозы седативных средств [1].
Целью паллиативной седации является максимально возможное сохранение способности пациента взаимодействовать с близкими и в то же время обеспечение адекватного купирования его симптомов и комфортного состояния за счет поддержания минимального уровня необходимой седации.
Пожелания пациента к паллиативной седации:
Такая седация может быть обеспечена за счет успокоительных или обезболивающих препаратов, вводимых для седативного воздействия, а не просто с помощью увеличения дозы лекарств, применяемых ранее для контроля симптомов (например, опиоидов), до уровня, когда седативный побочный эффект приведет к гиперседации, поскольку это может вызвать нежелательные побочные эффекты (например, миоклонию, тошноту).
Под рукой также должен быть план лечения стационарных и амбулаторных пациентов на случай чрезвычайной ситуации. Может понадобиться купирование внезапных и тяжелых симптомов в конце жизни, таких как сильное кровотечение, терминальное кислородное голодание, мучительный болевой кризис. В этом случае, чтобы облегчить страдания неизбежно умирающего пациента, может быть показано быстрое проведение агрессивной, глубокой и непрерывной седации [1].
Фармакология паллиативной седации
В медицинском сообществе нет консенсуса или научных доказательств, касающихся наиболее подходящих препаратов для осуществления паллиативной седации. Лекарственный препарат следует выбирать, основываясь на безопасности, эффективности и доступности [6]. В таблице 1 перечислены препараты и дозировки, которые обычно используются для паллиативной седации.
Лоразепам – это бензодиазепин, действующий дольше, чем мидазолам. В жидкой форме его можно применять орально или сублингвально. Печеночная или почечная недостаточность не влияют на его выведение. Таким образом, он незаменим для хосписной помощи на дому и часто входит в хосписный набор медикаментов для облегчения симптомов, особенно в концентрированной форме [1, 6].
Среди других препаратов, широко используемых для паллиативной седации, – антипсихотический хлорпромазин, барбитураты (фенобарбитал или первоначально пентобарбитал) и анестетический пропофол.
Лекарственные препараты для проведения паллиативной седации начинают давать с минимальной дозы и постепенно титруют вверх до минимально необходимой дозы, обеспечивающей облегчение или управление рефрактерными симптомами. Дополнительные дозы могут быть введены при необходимости [6].
Важно помнить, что индивидуальные дозы могут варьироваться, поскольку они зависят от массы тела больного, функционального состояния почек и печени, статуса гидратации и наличия сопутствующих симптомов.
Краткий перечень препаратов, наиболее часто используемых для паллиативной седации, и диапазон начальных доз [1]:
Мидазолам – 0,5 до 1 мг/час внутривенно/подкожно начальная внутривенная доза, от 0,5 до 5 мг по необходимости или нагрузочная доза;
Лоразепам – 0,5 до 5 мг орально/внутривенно/сублингвально, каждые 1–2 часа по необходимости, каждые 4–6 часов по расписанию;
Хлорпромазин – 12,5 до 25 мг внутривенно/внутримышечно каждые 2–4 часа, от 25 до 100 мг ректально каждые 4–12 часов;
Фенобарбитал – 1 до 3 мг/кг нагрузочная доза внутривенно, подкожно, затем – инфузия 0,5 мг/кг/час;
Пропофол – 20 мг нагрузочная доза внутривенно, затем длительная инфузия 10 мг/ч или 2,5 до 5 мг/кг/мин и увеличивать до 10–20 мг/час каждые 10 мин по необходимости;
Галоперидол – орально/внутримышечно/внутривенно, разовая доза – 0,5 мг, суточная – 0,5–15 мг [12].
Постепенное и прогнозируемое нарушение дыхания у терминальных больных не должно использоваться в качестве основания для уменьшения седативного эффекта. Оценка пациента должна включать тяжесть страданий, уровень сознания и неблагоприятные побочные эффекты [6].
Этические вопросы
Паллиативная седация поднимает этические вопросы в тех случаях, когда сознание больного медикаментозно снижается до такой степени, что пациент не в состоянии взаимодействовать с другими людьми, не имеет возможности скорректировать или изменить свое мнение и не в состоянии принимать пищу и воду.
С целью снятия и облегчения эмоциональных нагрузок и ответственности, связанных с уходом за такими больными в конце жизни, очень важно для медицинской команды проводить периодические конференции с разбором данных случаев и оказанием психологической поддержки персоналу [6].
Литература:
Bobb. B. Nurs Clin North Am. 2016, Sep.; 51 (3): 449–57.
Понкин И. В., Понкина А. А.. Паллиативная медицинская помощь. Понятие и правовые основы. 2014.
Twycross R. Regarding Palliative Sedation. Journal of Pain and Symptom Management. 2017. https://www.clinicalkey.com/#!/content/journal/1‑s2.
Maltoni M., Scarpi E., Rosat M. et al. Palliative sedation in end-of-life care and survival: a systematic review. J. Clin. Oncol. 2012; 30 (12: 1378–83. 456.
Cherney N. I., Portenoy R. K. Sedation in the management of refractory symptoms: guidelines for evaluation and treatment. J. Palliat. Care. 1994; 11 (2): 31–38.
Bruce S. D. Palliative Sedation in End-of-Life Care. Journal of Hospice and Palliative Nursing. 2006; 8 (6): 320–327.
Morita T. Palliative sedation to relieve psycho-existential suffering of terminally ill cancer patients. J Pain Symptom Manage. 2004, Nov.; 28 (5): 445–50.
Schur S., Weixler D., Gabl C., Kreye G., Likar R., Masel E. K., Mayrhofer M., Reiner F., Schmidmayr B., Kirchheiner K., Watzke H. H. Sedation at the end of life – a nation-wide study in palliative care units in Austria. BMC Palliative Care (2016) 15:50.
Statement on Palliative Sedation. December 5, 2014. http://aahpm.org/positions/palliative-sedation.
Danis M., Bellavance E., Silverman H. Ethical considerations in managing critically ill patients. Critical Care Medicine: Principles of Diagnosis and Management in the Adult, Fourth Edition Published January 1, 2014.
Kirk T. W. National Hospice and Palliative Care Organization (NHPCO) Position Statement and Commentary on the Use of Palliative Sedation in Imminently Dying Terminally Ill Patients. Journal of Pain and Symptom Management. Vol. 39. No. 5. May 2010. P. 914–923.
Хронический болевой синдром (ХБС) у взрослых пациентов в паллиативной медицинской помощи. МКБ‑10: R52.1, R52.2, 2016.