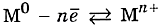Металлическая связь между чем и чем
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
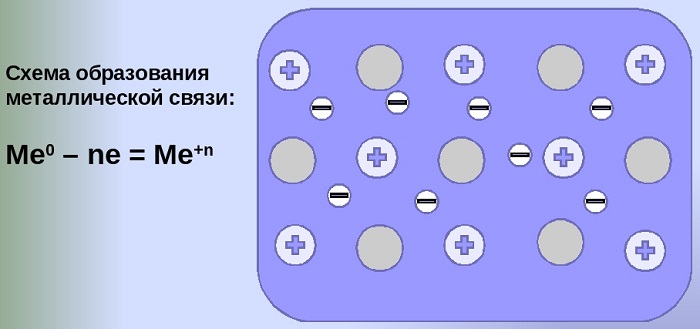
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
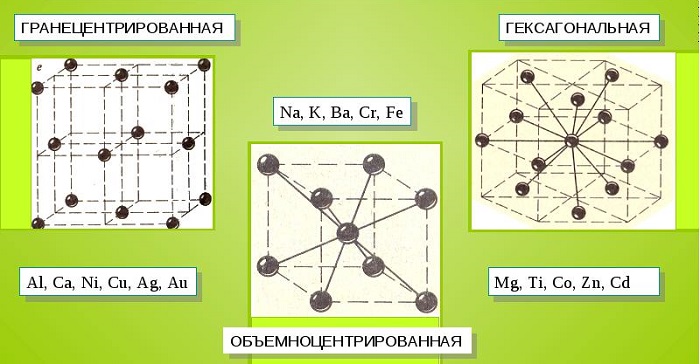
Характерные кристаллические решетки
Металлические кристаллы подразделяются на 3 основных типа:
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.
Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
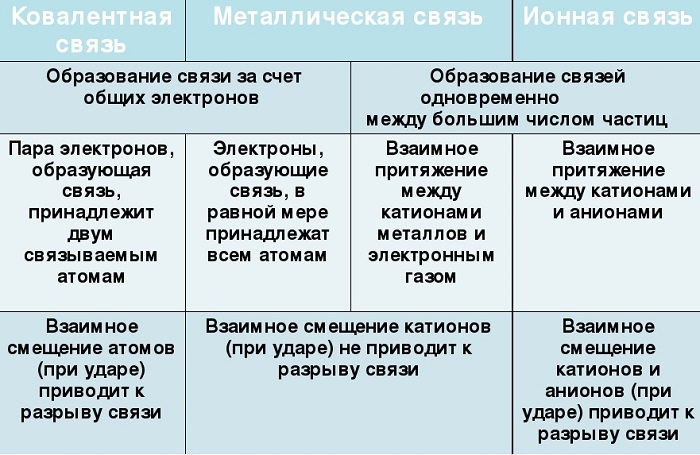
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
Металлическая связь
Металлическая связь — это одновременное существование положительно заряженных атомов и свободного электронного газа.
Содержание
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей – положительно заряженных ионов щелочного металла (рис.1). Кулоновское отталкивание одноимённо-заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра – квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной трансляционной решётке aw кристалла щелочного металла (рис.2).
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляцонной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щёлочный металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Постоянная решётка aw,Å [1] | 3,5021 | 4,2820 | 5,247 | 5,69 | 6,084 |
| Длина ковалентной связи, Me2, Å [2] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Свободное движение электронов в металле подтверждено в 1916 году опытом Толмена и Стюарта по резкому торможению быстро вращающейся катушки с проводом – свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Колебания ионов кристаллической решётки создаёт сопротивление движению электронов по металлу, сопровождающееся разогревом металла. В настоящее время важнейшим признаком металлов считается отрицательный температурный коэффициент электрической проводимости, то есть понижение проводимости с ростом температуры. С понижением температуры электросопротивление металлов уменьшается, вследствие уменьшения колебаний ионов в кристаллической решётке. В процессе исследования свойств материи при низких температурах Камерлинг-Оннес открывает явление сверхпроводимости. В 1911 году ему удаётся обнаружить уменьшение электросопротивления ртути при температуре кипения жидкого гелия (4,2 К) до нуля. В 1913 году Камерлинг-Оннесу присуждается Нобелевская премия по физике со следующей формулировкой: «За исследование свойств веществ при низких температурах, которые привели к производству жидкого гелия.»
Однако теория сверхпроводимости была создана позднее. В её основе лежит концепция куперовской электронной пары – коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ – Бардину, Куперу и Шрифферу присуждена Нобелевская премия по физике “За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Металлическая связь между чем и чем
Ключевые слова конспекта: Металлическая химическая связь: ион-атомы и электронный газ. Физические свойства металлов и их применение на основе этих свойств. Чёрные и цветные металлы. Сплавы.
Подавляющее число химических элементов периодической системы Д. И. Менделеева относятся к металлам:
Анализ положения металлов в периодической системе и учёт особенностей строения их атомов позволяет сделать следующие выводы: атомы этих элементов содержат небольшое число электронов на внешнем слое (1—3), имеют сравнительно большой радиус атома и много свободных орбиталей, которые могут легко перекрываться. Поэтому валентные электроны свободно перемещаются от одних атомов, превращая их в ионы, к другим, связывая их.
В простых веществах-металлах осуществляется бесконечный процесс превращения атомов в ионы и обратно, который можно отразить с помощью схемы:
Эти же процессы происходят и в металлических сплавах.
Металлическая связь определяет и особое кристаллическое строение металлов и сплавов — металлическую кристаллическую решётку, в узлах которой расположены ион–атомы. Обобществлённые подвижные электроны не принадлежат какому–то определённому атому и способны перемещаться по всему объёму металла. В отсутствие в нём электрического поля эти электроны хаотически движутся и сталкиваются, чаще всего с ионами кристаллической решётки. В 1900 г. немецкий физик Пауль Друде предложил называть совокупность этих электронов электронным газом. Этот электронный газ прочно соединяет, как бы склеивает ионный остов металла. При механических нагрузках или нагреве газ не допускает разрыва металлической решётки, связывая положительные ионы. Поэтому при обработке металлов изменение их формы происходит без разрушения кристаллической решётки, так как её слои легко скользят один по другому.
Металлы электропроводны, потому что под действием электрического поля валентные электроны начинают направленное движение — возникает электрический ток. Металлы — это проводники первого рода, в отличие от растворов электролитов, которые относятся к проводникам второго рода.
Мы вряд ли представляем себе жизнь без электричества, которое поступает в каждый дом, в каждую квартиру по сети электрических проводов своеобразной кровеносной системе современной технической цивилизации. Лучше всего проводят электрический ток серебро, медь, золото, алюминий. Серебро и золото — дорогие металлы. Медь также недешёвый металл. Поэтому кабели линий электропередачи (ЛЭП) делают главным образом из алюминия.
Кстати, прочная опора линии электропередачи тоже металлическая. Прочность — одно из основных свойств большинства металлов, позволяющее использовать их в качестве конструкционных материалов. Один из наиболее прочных и в то же время лёгких металлов — титан. Этот металл и сплавы на его основе — незаменимые конструкционные материалы в самолётостроении и космической технике.
Все металлы теплопроводны. Это свойство, как и нетоксичность некоторых металлов, лежит в основе их применения для производства кухонной посуды: кастрюль, сковородок, противней. Батареи центрального отопления должны быстро нагреваться поступающей в них водой и эффективно отдавать теплоту окружающему воздуху, поэтому их тоже изготавливают из металла.
Самыми теплопроводными металлами являются те, которые хорошо проводят электрический ток: серебро, медь, золото, алюминий.
Металлы обладают металлическим блеском. Блестят они потому, что отражают лучи света, а не пропускают их, как стекло, и не поглощают, как сажа. Окраска большинства металлов серебристо–белая, так как они в равной степени отражают все лучи видимой части спектра. Золото и медь частично поглощают коротковолновое излучение, поэтому обладают окраской от жёлтой до красно–коричневой. Самые блестящие металлы — ртуть, палладий, серебро и алюминий, поэтому отражатели прожекторов, автомобильных фар и фонарей покрывают тонким слоем палладия, алюминия или хрома. Почти все измельчённые в порошок металлы, кроме магния и алюминия, теряют блеск и превращаются в серые или чёрные порошки.
Пластичность металлов в сочетании с блеском делают их незаменимым материалом для художников. Самым пластичным по праву считается золото. Из одного грамма этого металла можно вытянуть нить длиной 2 км или раскатать фольгу толщиной 0,00008 мм. Такой тонкий листочек даже в руки взять невозможно: он сразу прилипнет к коже. Это свойство находит своё применение: тонкими золотыми листочками покрывают купола церквей, скульптуры, деревянную резьбу.
Современная техника и промышленность нуждаются в металлических материалах с самыми разнообразными и трудно сочетаемыми свойствами, которых нет у чистых металлов. На помощь технологам приходят сплавы.
| Сплавы — это металлические материалы, получаемые из расплавов двух или более веществ, одно из которых — металл. |
Например, из железосодержащих руд выплавляют чугун — сплав железа с углеродом, в котором массовая доля углерода составляет от 2 до 4%. Чугун — хрупкий материал, изделия из которого получают не ковкой, а литьём, как из пластмасс. Из чугуна изготавливают различные массивные конструкции: корпуса станков, турбин, детали двигателей, ограждения. Настоящее произведение искусства — ограды мостов и решётки парков Санкт–Петербурга.
Если из чугуна удалить излишек углерода и довести его содержание до 1—2%, получится сталь. В отличие от чугуна, она пластична, ковка, имеет гладкую блестящую поверхность. Сталь можно прокатать в тонкий лист или железнодорожный рельс, вытянуть в проволоку, согнуть уголком.
Для придания стали специфических свойств в неё добавляют другие металлы — так называемые легирующие добавки. Используя их, выплавляют сотни разных сортов стали. Нержавеющая сталь содержит хром и никель. В жаропрочную сталь добавляют вольфрам. Молибден придаёт стали твёрдость. Алюминий добавляют в сталь, идущую на изготовление кузовов автомобилей.
| Железо и сплавы на его основе называют чёрными металлами, а соответствующую отрасль промышленности — чёрной металлургией. Все остальные металлы и сплавы называют цветными. |
Сплав меди с оловом, бронза, обладает хорошими литейными свойствами. Из неё отливают не только колокола и художественные изделия, но и подшипники, вентили, клапаны и детали машин.
Сплав меди с цинком называют латунью. Она прочнее меди, устойчива к атмосферной коррозии. Из латуни изготавливают трубки, шестерни, армейские знаки отличия, химическое оборудование.
Нарядные столовые приборы, посуду, недорогие украшения изготавливают из мельхиора — сплава меди с никелем. Несмотря на то, что никеля в этом сплаве всего 20%, мельхиор лишён медного цвета и по внешнему виду напоминает серебро.
Сплав алюминия с медью, магнием и марганцем называют дуралюмин (дюраль) и используют в самолёто-, судо- и машиностроении.
Конспект урока по химии «Металлическая химическая связь». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Лекция по Химии на тему: «Металлическая химическая связь»
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
УЧЕБНАЯ ДИСЦИПЛИНА ХИМИЯ
Раздел: Типы химической связи
ТЕМА: Металлическая химическая связь
Познакомьтесь с лекционным материалом по теме.
Выполните тестовое задание (см. приложение №1)
Разгадайте тематический кроссворд (см. приложение №2)
Металлическая связь это тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Металлы – это химические элементы с низкой электроотрицательностью, поэтому они легко отдают свои валентные электроны. Если рядом с элементом металлом находится неметалл, то электроны от атома металла переходят к неметаллу. Такой тип связи называется ионный (рис. 1).
В случае простых веществ металлов или их сплавов, ситуация меняется.
При образовании молекул электронные орбитали металлов не остаются неизменными. Они взаимодействуют между собой, образуя новую молекулярную орбиталь. В зависимости от состава и строения соединения, молекулярные орбитали могут быть как близки к совокупности атомных орбиталей, так и значительно от них отличаться. При взаимодействии электронных орбиталей атомов металла образуются молекулярные орбитали. Такие, что валентные электроны атома металла, могут свободно перемещаться по этим молекулярным орбиталям. Не происходит полное разделение, заряда, т. е. металл – это не совокупность катионов и плавающих вокруг электронов. Но это и не совокупность атомов, которые иногда переходят в катионную форму и передают свой электрон другому катиону. Реальная ситуация – это совокупность двух этих крайних вариантов.
Рис. 2 Металлической кристаллическая решетка
Сущность образования металлической связи состоит в следующем: атомы металлов отдают наружные электроны, и некоторые из них превращаются в положительно заряженные ионы. Оторвавшиеся от атомов электроны относительно свободно перемещаются между возникшими положительными ионами металлов. Между этими частицами возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы в металлической решетке (рис. 2).
Наличие металлической связи обуславливает физические свойства металлов:
· Тепло и электропроводность
Пластичность – это способность материала легко деформироваться под действием механической нагрузки. Металлическая связь реализуется между всеми атомами металла одновременно, поэтому при механическом воздействии на металл не разрываются конкретные связи, а только меняется положение атома. Атомы металла, не связанные жесткими связями между собой, могут как бы скользить по слою электронного газа, как это происходит при скольжении одного стекла по другому с прослойкой воды между ними. Благодаря этому металлы можно легко деформировать или раскатывать в тонкую фольгу. Наиболее пластичные металлы – чистое золото, серебро и медь. Все эти металлы встречаются в природе в самородном виде в той или иной степени чистоты. Рис. 3.
Рис. 3. Металлы, встречающиеся в природе в самородном виде
Температура тела – это мера энергии составляющих его атомов или молекул. Электронный газ металла может довольно быстро передавать избыточную энергию с одного иона или атома к другому. Температура металла быстро выравнивается по всему объёму, даже если нагревание идет с одной стороны. Это наблюдается, например, если опустить металлическую ложку в чай.
Металлический блеск. Блеск – это способность тела отражать световые лучи. Высокой световой отражательной способностью обладают серебро, алюминий и палладий. Поэтому именно эти металлы наносят тонким слоем на поверхность стекла при изготовлении фар, прожекторов и зеркал.
ТЕСТ по теме: Металлическая химическая связь
1. Металлическая связь образуют
a) атомы различных неметаллов
c) атомы одинаковых неметаллов
d) атомы металлов и атомов неметаллов
2. У атомов металлов на внешнем уровне находится
a) от 2 до 3 электронов
b) от 4 до 5 электронов
c) от 1 до 3 электронов
d) от 2 до 4 электронов
3. Расположите химические элементы в порядке возрастания металлических свойств
4. Расположите химические элементы в порядке убывания металлических свойств
5. «Электронный газ» это
a) электроны внешнего энергетического уровня
b) валентные электроны
c) неспаренные электроны в атоме
d) свободные электроны в кристалле металла
6. Определите вид химической связи в веществах
1) литий; 2) аммиак; 3) хлор 4) хлорид бария
b) ковалентная неполярная
c) ковалентная полярная
7. Сходство металлической связи с ионной в
a) обобществлении электронов
b) образовании свободных атомов
c) образовании ионов
d) образовании электронов
8. Сходство ковалентной и металлической связи в
a) образовании свободных атомов
b) образовании ионов
c) образовании электронов
d) обобществлении электронов
9. Металлическая связь обуславливает следующие физические свойства (выберите 3 правильных ответа)
a) высокая электропроводность
Кроссворд по теме: Металлическая связь

Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.